-
Cantidad de oxígeno y volumen de hidrógeno al descomponer agua (799)
El agua se puede descomponer en hidrógeno, 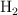 , y oxígeno,
, y oxígeno, 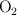 . Si tratamos 300 g de agua en una cuba electrolítica, ¿qué cantidad de oxígeno se obtendrá? ¿Qué volumen de hidrógeno se obtendrá, medido en condiciones normales?
. Si tratamos 300 g de agua en una cuba electrolítica, ¿qué cantidad de oxígeno se obtendrá? ¿Qué volumen de hidrógeno se obtendrá, medido en condiciones normales?
Masas atómicas: H = 1 ; O = 16.
-
Cálculos en la reacción entre el agua oxigenada y el dióxido de azufre (795)
Cuando se hace reaccionar el dióxido de azufre con el agua oxigenada, se produce ácido sulfúrico, según la reacción:
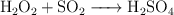
a) Determina los moles de ácido que se obtienen a partir de 12 L de  , medidos a 1 atm de presión y
, medidos a 1 atm de presión y 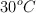 de temperatura, si reaccionan con agua oxigenada en exceso.
de temperatura, si reaccionan con agua oxigenada en exceso.
b) Los moles de ácido si los litros anteriores reaccionan con 10 g de 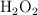
-
Balanceo de reacciones químicas de distinto tipo (794)
Ajusta las siguientes reacciones químicas:
a) 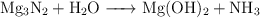
b) 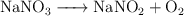
c) 
d) 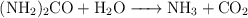
-
Ajuste de reacciones químicas de distinto tipo (793)
Ajusta las siguientes reacciones químicas:
a) 
b) 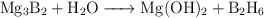
c) 
d) 
-
Masa y moles de amoniaco que han reaccionado con el óxido de plomo (780)
En el proceso:
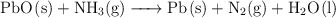
se hacen reaccionar 50 g de 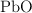 y se obtienen 46 g de
y se obtienen 46 g de 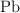 , 0.075 moles de
, 0.075 moles de 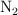 y 0.224 moles de
y 0.224 moles de 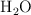 . ¿Qué masa de
. ¿Qué masa de 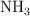 habrá reaccionado? ¿Cuántos moles son?
habrá reaccionado? ¿Cuántos moles son?
Solo puedes usar para hacer el problema la masa atómica del N (14 u), la del H (1 u) y la del O (16 u).
 Reacciones químicas
Reacciones químicas