-
Volumen de aire necesario para quemar dos litros y medio de gasolina (103)
La gasolina es una mezcla de hidrocarburos entre los que se encuentra el octano, 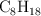 .
.
a) Escribe la reacción ajustada para la combustión del octano.
b) Sabiendo que el porcentaje de oxígeno en el aire es del 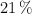 en volumen, calcula el volumen de aire, medido en condiciones normales, que se necesita para quemar 2.5 L de octano de densidad 0.703 kg/L.
en volumen, calcula el volumen de aire, medido en condiciones normales, que se necesita para quemar 2.5 L de octano de densidad 0.703 kg/L.
Datos: C = 12; O = 16; H = 1.
-
Problema de estequiometría 0007
Una muestra de 27,37 g de potasio metálico reacciona con oxígeno, convirtiéndose en óxido de potasio. La masa de éste es 32,97 g. Utilizando como único dato la masa atómica del oxígeno (O = 16 u), calcula la masa atómica del potasio.
-
Problema de estequiometría 0006
El cinc se disuelve en ácido sulfúrico formando sulfato de cinc e hidrógeno. ¿Qué masa de cinc puede disolverse en 500 mL de ácido sulfúrico al 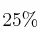 en peso y de densidad 1,09 g/mL? ¿Qué volumen de hidrógeno, medido en condiciones normales, se desprenderá en la reacción?
en peso y de densidad 1,09 g/mL? ¿Qué volumen de hidrógeno, medido en condiciones normales, se desprenderá en la reacción?
Datos: Zn = 65,41 ; S = 32 ; O = 16 ; H = 1
-
Volumen y moéculas de oxígeno que se obtienen al descomponer KClO3 impuro (100)
El clorato de potasio se descompone por el calor en cloruro de potasio y oxígeno molecular. ¿Qué volumen de oxígeno, a 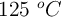 y una atmósfera de presión, puede obtenerse por descomposición de 148 g de una muestra que contiene el
y una atmósfera de presión, puede obtenerse por descomposición de 148 g de una muestra que contiene el 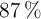 en peso de clorato potásico? ¿Cuántas moléculas de oxígeno se formarán?
en peso de clorato potásico? ¿Cuántas moléculas de oxígeno se formarán?
Datos: Cl = 35.45 ; O = 16 ; K = 39.1
-
Cantidad de SO2 y volumen de aire al tostar pirita (99)
En la tostación de la pirita:
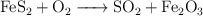
determina:
a) La cantidad de 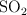 que se obtiene al tostar 2 toneladas de pirita de un
que se obtiene al tostar 2 toneladas de pirita de un 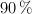 de riqueza, si el resto es ganga silícica.
de riqueza, si el resto es ganga silícica.
b) El volumen de aire, medido a 298.15 K y 1 atm de presión, que se necesita para tostar dicha cantidad de mineral. (El porcentaje de 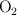 en el aire es del
en el aire es del 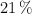 ).
).
Datos: Fe = 55.85 ; S = 32 ; O = 16
 Reacciones químicas
Reacciones químicas