-
PAU equilibrio químico 0005
Para la reacción 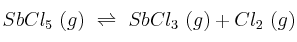 , el valor de
, el valor de  a la temperatura de 182 ºC, vale
a la temperatura de 182 ºC, vale 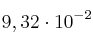 . En un recipiente de 0,40 litros se introducen 0,2 moles de pentacloruro y se eleva la temperatura a 182 ºC hasta que se establece el equilibrio anterior. Calcula:
. En un recipiente de 0,40 litros se introducen 0,2 moles de pentacloruro y se eleva la temperatura a 182 ºC hasta que se establece el equilibrio anterior. Calcula:
a) La concentración de las especies en el equilibrio.
b) La presión de la mezcla gaseosa.
-
PAU equilibrio químico 0003
En un recipiente de 0,5 L, y a cierta temperatura, se introducen 10 g de 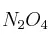 . Cuando se alcanza el equilibrio:
. Cuando se alcanza el equilibrio:
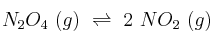
la constate  vale 0,182 M.
vale 0,182 M.
a) ¿Cuáles son las concentraciones en el equilbrio?
b) Suponiendo que la reacción es endotérmica, ¿será mayor  si aumentamos el valor de la temperatura del sistema? Razona tu respuesta.
si aumentamos el valor de la temperatura del sistema? Razona tu respuesta.
-
PAU equilibrio químico 0002
Una mezcla gaseosa constituida inicialmente por 3,5 moles de hidrógeno y 2,5 moles de yodo se calienta a 400 ºC, con lo que al alcanzar el equilibrio se obtienen 4,5 moles de HI, siendo el volumen del recipiente de 10 L. Calcula:
a) El valor de las constantes  y
y  .
.
b) La concentración de los compuestos si el volumen se reduce a la mitad manteniendo constante la temperatura de 400 ºC.
-
Equilibrio químico: moles de producto y formas de aumentar la producción (643)
La constante de equilibrio  para la reacción:
para la reacción:
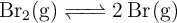
es 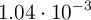 a
a 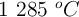 . Un recipiente de 200 mL contiene, una vez alcanzado el equilibrio,
. Un recipiente de 200 mL contiene, una vez alcanzado el equilibrio, 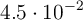 moles de
moles de 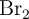 .
.
a) ¿Cuántos moles de Br estarán presentes en el matraz?
b) La reacción de disociación del 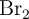 es endotérmica. ¿Qué se puede hacer para aumentar la cantidad de bromo atómico?
es endotérmica. ¿Qué se puede hacer para aumentar la cantidad de bromo atómico?
c) ¿Cuáles de las medidas adoptadas en el apartado anterior afectan al valor de  ?
?
-
Problema equilibrio químico 0013
Calcula, a 500 ºC, el valor de  para el equilibrio:
para el equilibrio:
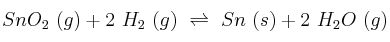
sabiendo que el análisis de una mezcla de éstas cuatro sustancias, en el equilibrio, indica que ![[H_2O] = [H_2] = 0,1\ M [H_2O] = [H_2] = 0,1\ M](local/cache-TeX/67db477471d2560775b5b0be1098b782.png) . Si se añade hidrógeno molecular hasta subir, momentáneamente, su concentración a 0,2 moles/L, ¿cuáles serán las concentraciones de los gases cuando se restablezca el equilibrio?
. Si se añade hidrógeno molecular hasta subir, momentáneamente, su concentración a 0,2 moles/L, ¿cuáles serán las concentraciones de los gases cuando se restablezca el equilibrio?
 Concentraciones
Concentraciones