-
EBAU Andalucía: química (junio 2011) - ejercicio B.5 (1469)
La reacción utilizada para la soldadura aluminotérmica es:

a) Calcula el calor a presión constante y el calor a volumen constante intercambiados en condiciones estándar y a la temperatura de la reacción.
b) ¿Cuántos gramos de 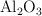 se habrán obtenido cuando se desprendan 10 000 kJ en la reacción?
se habrán obtenido cuando se desprendan 10 000 kJ en la reacción?
Datos: ![\Delta H_f^0[\ce{Al2O3(s)}] = -1\ 675.7\ \textstyle{kJ\over mol} \Delta H_f^0[\ce{Al2O3(s)}] = -1\ 675.7\ \textstyle{kJ\over mol}](local/cache-TeX/2ba094f3330e87f9f50f2e95efd96bf4.png) ;
; ![\Delta H_f^0[\ce{Fe2O3(s)}] = -824.2\ \textstyle{kJ\over mol} \Delta H_f^0[\ce{Fe2O3(s)}] = -824.2\ \textstyle{kJ\over mol}](local/cache-TeX/9710a518ff4619be02125e6d1c96d0a6.png) . Masas atómicas: Al = 27 ; O = 16.
. Masas atómicas: Al = 27 ; O = 16.
-
Entalpía de formación y calor de combustión 0002
La entalpía de combustión de un hidrocarburo gaseoso 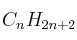 es -2220 kJ/mol. Calcule:
es -2220 kJ/mol. Calcule:
a) La fórmula molecular de este hidrocarburo.
b) La energía desprendida en la combustión de 50 L de este gas, medidos a 25 ºC y 1 atm.
c) La masa de 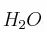 (l) que se obtendrá en la combustión anterior.
(l) que se obtendrá en la combustión anterior.
Datos: R = 0,082 atm·L/K·mol ; Entalpías de formación (kJ/mol):  (g) = -393 ;
(g) = -393 ; 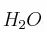 (l) = -286 ;
(l) = -286 ; 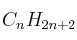 = -106 ; Masas atómicas: H = 1 ; O = 16 ; C = 12.
= -106 ; Masas atómicas: H = 1 ; O = 16 ; C = 12.
-
Entalpía de formación y calor de combustión 0001
El calor de combustión del butano gaseoso a presión constante de 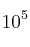 Pa y 25 ºC es -2879 kJ/mol. Sabiendo que las entalpías estándar de formación de
Pa y 25 ºC es -2879 kJ/mol. Sabiendo que las entalpías estándar de formación de  (g) y
(g) y 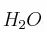 (l) son -393,5 kJ/mol y -285,8 kJ/mol respectivamente, calcula:
(l) son -393,5 kJ/mol y -285,8 kJ/mol respectivamente, calcula:
a) La entalpía estándar de formación del butano.
b) El calor de combustión a volumen constante del butano a 25 ºC.
Dato: 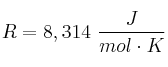
-
Problema de entalpía de reacción 0014
En la combustión de cierta cantidad de propano se han obtenido 14,66 L de  medidos en condiciones estándar, desprendiéndose 444 kJ:
medidos en condiciones estándar, desprendiéndose 444 kJ:
a) Determina la entalpía de reacción estándar del propano en kJ/mol.
b) ¿Cuál será la entalpía de formación del propano en condiciones estándar?
Datos: ![\Delta H_f^0\ [CO_2 (g)] = - 393,5\ kJ/mol \Delta H_f^0\ [CO_2 (g)] = - 393,5\ kJ/mol](local/cache-TeX/776b47f03232604792be4fef10c16bb6.png) ;
; ![\Delta H_f^0\ [H_2O (l)] = - 285,5\ kJ/mol \Delta H_f^0\ [H_2O (l)] = - 285,5\ kJ/mol](local/cache-TeX/4d6ae293f8f1c103d520959707990107.png) ; C: 12 ; O: 16 ; H: 1.
; C: 12 ; O: 16 ; H: 1.
-
PAU termoquímica 0003
Sabiendo que los calores de combustión de 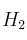 (g), C (s) y
(g), C (s) y 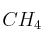 (g) son respectivamente: -68,40 ; -95,29 y -200,10 kcal/mol:
(g) son respectivamente: -68,40 ; -95,29 y -200,10 kcal/mol:
a) Escribe las ecuaciones termoquímicas que describen los tres procesos.
b) Calcula el calor de formación del metano. ¿Es un proceso endotérmico? ¿Por qué?
 Entalpía
Entalpía