-
Aplicación de la Ley de la conservación de la masa (1060)
¿Cuál será la masa de oxígeno necesaria para la combustión completa de 1.22 g de magnesio, sabiendo que al final de la reacción se obtienen 2.02 g de óxido de magnesio? ¿En qué ley fundamental se basa la respuesta?
-
Problema leyes ponderales 0011
Se hacen reaccionar 30 g de silicio con 50 g de oxígeno. Calcular la masa y el número de moles de las especies resultantes después de la reacción:
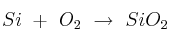
Datos: Si = 28 ; O = 16.
-
Problema leyes ponderales 0010
2,5 g de cobre reaccionan con cloro para dar un 5,3 g de compuesto. ¿Qué cantidad de cobre reaccionará con 1200 mL de cloro gaseoso en condiciones normales? ¿Qué cantidad de compuesto se formará?
Dato: Cl = 35,5 ; Cu = 63,5
-
Leyes ponderales: ley de Lavoisier y ley de Proust (838)
Calentamos una muestra de 2.5 g de estaño puro al aire hasta que se obtienen 3.17 g de producto. ¿Qué cantidad de oxígeno ha reaccionado con el estaño? Si hubiésemos calentado 6 g de estaño con solo 1 g de oxígeno, ¿cuánto producto se habría formado?
-
Ley de conservación de la masa y ley de Proust (782)
Hacemos reaccionar en el laboratorio 12 g azufre y 21 g de hierro para formar sulfuro hierro (FeS):
a) ¿Qué cantidad de FeS obtendremos?
b) ¿Cuánto hierro sería necesario para hacer reaccionar 32 g de azufre?
 Conservación de la Masa
Conservación de la Masa