-
Molaridad tras la dilución de una solución concentrada de ácido sulfúrico (1837)
Se toman 25 mL de un ácido sulfúrico de densidad 1.84 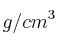 y del 96
y del 96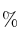 de riqueza en peso y se le adiciona agua hasta 250 mL.
de riqueza en peso y se le adiciona agua hasta 250 mL.
a) Calcula la molaridad de la disolución anterior.
b) Describe el material necesario y el procedimiento a seguir para preparar la disolución.
Masas atómicas: H = 1 ; S = 32 ; O = 16
-
Disoluciones: Dilución (1649)
¿Hasta qué volumen hay que diluir 250 mL de 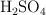 0.15 M para obtener una disolución 0.025 M?
0.15 M para obtener una disolución 0.025 M?
-
Preparación de disoluciones 0001
Se prepara 1 L de disolución acuosa de ácido clorhídrico 0,5 M a partir de uno comercial de riqueza 35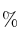 en peso y 1,15 g/mL de densidad. Calcule:
en peso y 1,15 g/mL de densidad. Calcule:
a) El volumen de ácido concentrado necesario para preparar dicha disolución.
b) El volumen de agua que hay que añadir a 20 mL de HCl 0,5 M, para que la disolución pase a ser 0,01 M.
Suponga que los volúmenes son aditivos. Masas atómicas: H = 1; Cl = 35,5.
-
Problema disoluciones 0009
Disolvemos 25 mL de ácido nítrico 0,2 M con agua pura hasta un volumen total de 200 mL y la etiquetamos como "Disolución A". Se toman 30 mL de la disolución A y se llevan hasta 100 mL con agua pura para obtener la "Disolución B".
a) ¿Cuál es la molaridad de la disolución B?
b) ¿Cuántos átomos de nitrógeno contienen 2 mL de disolución B?
Datos: 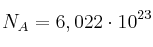 ; N: 14 ; O: 16 ; H: 1.
; N: 14 ; O: 16 ; H: 1.
-
Volumen de una disolución que contiene una masa de soluto determinada
Se ha preparado una disolución de 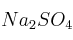 en agua de una concentración 2 M. ¿Qué volumen de la misma tendríamos que tomar para asegurarnos de que tenemos 500 mg de Na?
en agua de una concentración 2 M. ¿Qué volumen de la misma tendríamos que tomar para asegurarnos de que tenemos 500 mg de Na?
 Dilución
Dilución