-
Cuestión equilibrio químico 0016
Se estudia el siguiente equilbrio:
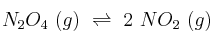
cuya  a 298 K es 0,15.
a 298 K es 0,15.
a) ¿En qué sentido evolucionará, hasta alcanzar el equilibrio, una mezcla de ambos gases cuya presión parcial sea la misma e igual a 1 atm?
b) Si una vez alcanzado el equilibrio se comprime la mezcla, ¿qué le ocurrirá a la cantidad de 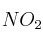 ?
?
c) Si un aumento de la temperatura provoca un aumento de la concentración de 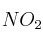 , ¿cómo será la reacción de descomposición del
, ¿cómo será la reacción de descomposición del 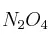 : endotérmica o exotérmica?
: endotérmica o exotérmica?
-
Cuestión equilibrio químico 0015
Para el sistema en equilibrio:
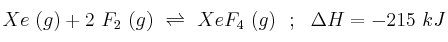
Explica qué efecto tendrá sobre el equilibrio:
a) Aumentar el volumen del recipiente.
b) Añadir más flúor.
c) Disminuir la temperatura del sistema.
d) Comprimir el sistema.
-
Cuestión equilibrio químico 0014
Dada la reacción:
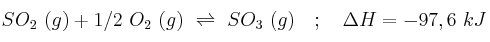
Explica tres formas de aumentar la cantidad de 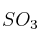 producido.
producido.
-
Cuestión equilibrio químico 0013
Considera este proceso en equilibrio a 800 ºC:
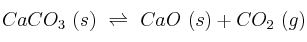
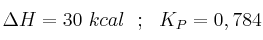
a) ¿Se puede descomponer cualquier cantidad de carbonato de calcio en un recipiente cerrado a 800 ºC?
b) Indica, razonadamente, cuáles de las siguientes medidas favorecen la descomposición de una cantidad determinada de carbonato de calcio:
– Añadir dióxido de carbono.
– Aumentar el volumen del recipiente.
– Aumentar la temperatura del sistema.
-
Equilibrio químico: moles de producto y formas de aumentar la producción (643)
La constante de equilibrio  para la reacción:
para la reacción:
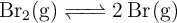
es 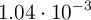 a
a 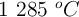 . Un recipiente de 200 mL contiene, una vez alcanzado el equilibrio,
. Un recipiente de 200 mL contiene, una vez alcanzado el equilibrio, 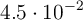 moles de
moles de 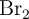 .
.
a) ¿Cuántos moles de Br estarán presentes en el matraz?
b) La reacción de disociación del 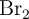 es endotérmica. ¿Qué se puede hacer para aumentar la cantidad de bromo atómico?
es endotérmica. ¿Qué se puede hacer para aumentar la cantidad de bromo atómico?
c) ¿Cuáles de las medidas adoptadas en el apartado anterior afectan al valor de  ?
?
 Le Chatelier
Le Chatelier