-
Masas mínimas de reactivos para obtener una masa de producto cuando el rendimiento es menor del 100%
Dada la siguiente ecuación química:
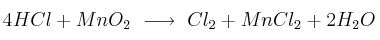
Calcula el volumen mínimo de solución de HCl al  (m/V) y la cantidad mínima de
(m/V) y la cantidad mínima de 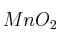 que se deberá poner en contacto si se desean producir 63 g de cloruro de manganeso, siendo el rendimiento de la reacción el
que se deberá poner en contacto si se desean producir 63 g de cloruro de manganeso, siendo el rendimiento de la reacción el 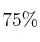 .
.
Datos: Mn = 55 ; Cl = 35,5 ; H = 1 ; O = 16.
-
Volumen de hidrógeno que se obtiene al reaccionar níquel con ácido nítrico (5810)
Se hace reaccionar en un recipiente 23.5 g de una lámina de níquel metálico con acido nítrico al 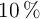 (m/V) según la reacción:
(m/V) según la reacción:
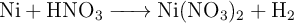
a) ¿Qué volumen de 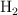 , a una presión de 912 mm Hg y a
, a una presión de 912 mm Hg y a 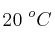 , se obtiene si la reacción se produce con un rendimiento del
, se obtiene si la reacción se produce con un rendimiento del 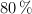 ?
?
b) ¿Qué volumen mínimo necesito agregar al recipiente para que se produzca la reacción?
-
Aplicación de reactivo limitante, pureza de reactivos y rendimiento de reacción (5176)
Se dispone de 87 g de nitrato de plata, con el 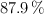 de pureza, que reacciona con 50 mL de una disolución de ácido clorhídrico, al
de pureza, que reacciona con 50 mL de una disolución de ácido clorhídrico, al 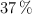 en masa y densidad 1.07 g/mL, obteniéndose cloruro de plata y ácido nítrico, siendo el rendimiento de la reacción del
en masa y densidad 1.07 g/mL, obteniéndose cloruro de plata y ácido nítrico, siendo el rendimiento de la reacción del 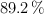 .
.
a) Escribe la reacción química y ajústala si fuera necesario.
b) Calcula la cantidad de cloruro de plata y de ácido nítrico que se obtiene en la reacción.
c) Determina la cantidad del reactivo en exceso que no reacciona.
Masas atómicas: H = 1 ; O = 16 ; N = 14 ; Cl = 35.5 ; Ag = 108.
-
Volumen de disolución e hidrógeno producido en una reacción 0001
Se tratan de 45 g de zinc con una disolución 2 M de ácido clorhídrico. Calcula el volumen de hidrógeno desprendido, medido a 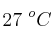 y 690 mm Hg, así como el volumen de disolución que se necesitará para ello, siendo la reacción:
y 690 mm Hg, así como el volumen de disolución que se necesitará para ello, siendo la reacción:
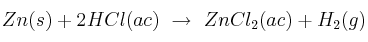
-
Estequiometría: reactivos en disolución 0001
X y W reaccionan según la siguiente ecuación química:
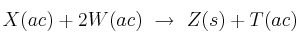
Se toman 50 mL de una disolución de X 0,1 M y se mezclan con 10 mL de disolución 0,2 M de W. Sería válido afirmar que quedan en disolución:
a) 0,003 mol de W.
b) 0,005 mol de X.
c) 0,001 mol de W.
d) 0,004 mol de X.
 Disoluciones
Disoluciones