-
Energía libre de Gibbs y espontaniedad (1614)
La entalpía de reacción estándar de la reacción entre el metano y el dicloro para dar clorometano y cloruro de hidrógeno es 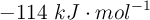 . Sabiendo que la variación de entropía estándar es
. Sabiendo que la variación de entropía estándar es 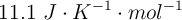 , calcula la variación de la energía libre de Gibbs estándar, a
, calcula la variación de la energía libre de Gibbs estándar, a 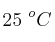 , y decide si el proceso el espontáneo o no en estas condiciones.
, y decide si el proceso el espontáneo o no en estas condiciones.
-
Cuestión termoquímica 0001
¿Puede ser espontánea una reacción endotérmica cuya variación de entropía sea positiva? ¿Por qué?
-
EBAU Andalucía: química (junio 2010) - ejercicio A.4 (1037)
Razona si las siguientes afirmaciones son verdaderas o falsas:
a) La entalpía de formación estándar del mercurio líquido, a  , es cero.
, es cero.
b) Todas las reacciones químicas en que 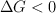 son muy rápidas.
son muy rápidas.
c) A 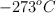 la entropía de una sustancia cristalina pura es cero.
la entropía de una sustancia cristalina pura es cero.
-
PAU espontaneidad 0002
Dada la reacción: 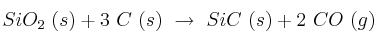
a) Halla la entalpía de la reacción .
b) Suponiendo que 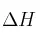 y
y 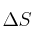 no varíen con la temperatura, ¿a partir de qué temperatura el proceso es espontáneo?
no varíen con la temperatura, ¿a partir de qué temperatura el proceso es espontáneo?
Datos: 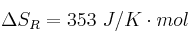 ;
; ![\Delta H^0_f[SiC(s)] = -65,3\ kJ/mol \Delta H^0_f[SiC(s)] = -65,3\ kJ/mol](local/cache-TeX/6095aa7f66621a8f0b4430e06ff5091e.png) ;
; ![\Delta H^0_f[SiO_2(s)] = -911\ kJ/mol \Delta H^0_f[SiO_2(s)] = -911\ kJ/mol](local/cache-TeX/895dfae339a8f1b86a560494f12b485b.png) ;
; ![\Delta H^0_f[CO(g)] = -111\ kJ/mol \Delta H^0_f[CO(g)] = -111\ kJ/mol](local/cache-TeX/092c6ca44e559b2ded936c2f2331c3cc.png)
-
PAU espontaneidad 0001
Dadas las ecuaciones termoquímicas:
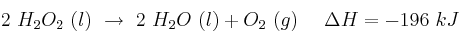
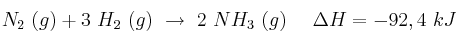
a) Define el concepto de entropía y explica el signo más probable para la variación de entropía en cada proceso.
b) Discute la espontaneidad de los procesos.
 Espontaneidad
Espontaneidad