-
Masa de clorato de potasio necesaria para obtener una masa de oxígeno (7768)
¿Cuántos gramos de clorato de potasio (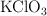 ) se tienen que descomponer para obtener 367.8 g de
) se tienen que descomponer para obtener 367.8 g de  ? ¿Qué masa de cloruro de potasio se formará?
? ¿Qué masa de cloruro de potasio se formará?
Datos: K = 39 ; Cl = 35.5 ; O = 16.
-
Reacción de corrosión del hierro y moles de óxido (7447)
A partir de la ecuación química que representa la corrosión del hierro, determina cuántos moles de 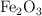 se pueden producir, si reaccionan 5 moles de hierro.
se pueden producir, si reaccionan 5 moles de hierro.
-
Reactivo limitante, masa de urea y masa de reactivo excedente (7109)
La urea se prepara según la siguiente reacción:
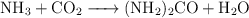
se hacen reaccionar 637.3 g de 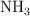 con 1 141 g de
con 1 141 g de  , calcula:
, calcula:
a) El reactivo limitante.
b) La masa de 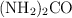 formada.
formada.
c) La cantidad del reactivo excedente en gramos al finalizar la reacción.
-
Estequiometría de la combustión del butanol (7077)
Dada la reacción de combustión del butanol:

a) Balancea la ecuación y establece la relación estequiométrica en moles.
b) Calcula las masas moleculares de todas las sustancias y establece la relación másica.
Si se hacen reaccionar 200g de 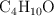 con 400 g de
con 400 g de  :
:
c) Determina cuál es el reactivo limitante y cuántos moles de  se necesitan para obtener 50 L de
se necesitan para obtener 50 L de  en condiciones normales de P y T.
en condiciones normales de P y T.
-
Volumen de nitrógeno y moléculas de oxígeno necesarias para una reacción (7000)
El nitrógeno reacciona con el oxígeno para formar el tetraóxido de dinitrógeno.
a) Escribe la ecuación química sabiendo que todas las sustancias son gaseosas.
b) Calcula el volumen de nitrógeno, medido en condiciones normales, que sería necesario para obtener 34 g de tetraóxido de dinitrógeno.
c) ¿Cuántas moléculas de oxígeno reaccionarán?
Datos: N = 14 ; O = 16 ; 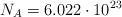 .
.
 Ajuste
Ajuste