-
PAU entalpía 0008
En condiciones estándar, en la combustión de 1 gramo de etanol se desprenden 29,8 kJ y en la combustión de 1 gramo de ácido acético se desprenden 14,5 kJ. Calcula:
a) La entalpía de combustión estándar del etanol y la del ácido acético.
b) La variación de entalpía estándar de la siguiente reacción:
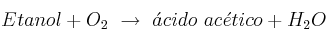
Masas atómicas: C = 12; H = 1; O = 16.
-
PAU ley de Hess 0003
Calcula la variación de entalpía de la fermentación de la glucosa según la reacción:
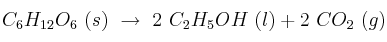
si las entalpías de combustión de la glucosa y del etanol son -2813 kJ/mol y -1367 kJ/mol, respectivamente.
-
Ley de Hess: entalpía de formación del hexano (556)
Sabiendo que las entalpías estándar de combustión del hexano (l), del carbono (s) y del hidrógeno (g) son, respectivamente: -4 192 kJ/mol, -393.5 kJ/mol y -285.8 kJ/mol, calcula:
a) La entalpía de formación del hexano líquido en esas condiciones.
b) Los gramos de carbono consumidos en la formación del hexano cuando se han intercambiado 50 kJ.
-
PAU ley de Hess 0001
a) Escribe las ecuaciones de combustión del ácido butanoico, el hidrógeno y el carbón.
b) Indica cuáles de los reactivos o productos de esas reacciones tienen una entalpía de formación nula en condiciones estándar.
c) Aplicando la ley de Hess, explica cómo calcularías la entalpía de formación del ácido butanoico a partir de las entalpías de combustión de las reacciones del apartado a).
-
Ley de Hess para calcular la entalpía de combustión del butano (456)
Conocidas las entalpías estándar de formación del gas butano, (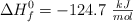 ) , agua (
) , agua (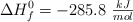 ) y dióxido de carbono (
) y dióxido de carbono (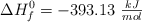 ) , calcula la entalpía estándar de combustión del butano.
) , calcula la entalpía estándar de combustión del butano.
 Ley de Hess
Ley de Hess