-
Problema reacciones redox 0006
En medio básico, el sulfito se oxida a sulfato en presencia de permanganato que pasa a dióxido de manganeso. Calcula la cantidad de permanganato potásico necesaria para oxidar 3,45 g de sulfito de bario.
Datos: Mn = 55 ; K = 39,1 ; O = 16 ; S = 32 ; Ba = 137,3.
-
Problema reacciones redox 0005
El yodo reacciona con el ácido nítrico para dar ácido yódico, dióxido de nitrógeno y agua. Si tenemos que hacer reaccionar 2,5 g de yodo con una disolución 2 M de ácido nítrico, ¿qué volumen de disolución necesitaremos?
Dato: I = 127.
-
Problema reacciones redox (588)
Ajusta la ecuación de oxidación-reducción:
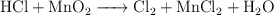
¿Qué volumen de cloro, medido en condiciones estándar, se obtiene cuando reaccionan 120 g del dióxido de manganeso?
Datos: Mn = 55 ; O = 16 ; Cl = 35.5.
-
Problema reacciones redox (587)
Ajusta, por el método ión-electrón, la reacción:

¿Qué cantidad de dicromato de potasio será necesaria para hacer reaccionar 15 g de azufre, suponiendo que la reacción se da completamente?
Datos: K = 39.1 ; Cr = 52 ; O = 16.
-
Problema reacciones redox (136)
Al reaccionar estaño con ácido nítrico, el estaño se oxida a dióxido de estaño y se desprende óxido de nitrógeno(II). a) Escribe la ecuación ajustada de esta reacción, por el método del ion-electrón. b) Si el estaño forma parte de una aleación y de 1 kg de la misma se obtienen 0.382 kg de dióxido de estaño, halla el porcentaje de estaño en la aleación.
(Masas atómicas: N = 14, Sn = 118.7, O = 16, H = 1).
 Ion-electrón
Ion-electrón