-
PAU Andalucía septiembre 2012: Equilibrio químico
En un recipiente que tiene una capacidad de 4 L, se introducen 5 moles de 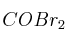 (g) y se calienta hasta una temperatura de 350 K. Si la constante de disociación del
(g) y se calienta hasta una temperatura de 350 K. Si la constante de disociación del 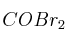 (g) para dar CO (g) y
(g) para dar CO (g) y 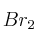 (g) es
(g) es  = 0,190. Determina:
= 0,190. Determina:
a) El grado de disociación y la concentración de las especies en equilibrio.
b) A continuación, a la misma temperatura, se añaden 4 moles de CO al sistema. Determina la nueva concentración de todas las especies una vez alcanzado el equilibrio.
-
Concentraciones en el equilibrio y constante de disociación 0001
Para el equilibrio 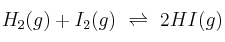 , la constante de equilibrio
, la constante de equilibrio  es 54,8 a la temperatura de 425 ºC. Calcula:
es 54,8 a la temperatura de 425 ºC. Calcula:
a) Las concentraciones de todas las especies en el equilibrio si se calientan, a la citada temperatura, 0,60 moles de HI y 0,10 moles de 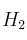 en un recipiente de un litro de capacidad.
en un recipiente de un litro de capacidad.
b) El porcentaje de disociación del HI.
-
Constante de equilibrio y presiones parciales 0001
A 523 K las concentraciones de 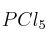 ,
, 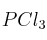 y
y 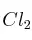 en equilibrio para la reacción:
en equilibrio para la reacción:
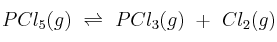
son 0,809 M, 0,190 M y 0,190 M, respectivamente. Calcule a esa temperatura:
a) Las presiones parciales de las tres especies en el equilibrio.
b) La constante  de la reacción.
de la reacción.
-
Constantes de equilibrio y grado de disociación 0001
En un recipiente se introduce una cierta cantidad de 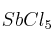 y se calienta a 182 ºC, alcanzando la presión de una atmósfera y estableciéndose el equilibrio:
y se calienta a 182 ºC, alcanzando la presión de una atmósfera y estableciéndose el equilibrio:
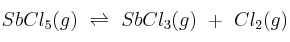
Sabiendo que en las condiciones anteriores el 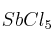 se disocia en un 29,2
se disocia en un 29,2 . Calcule:
. Calcule:
a) Las constantes de equilibrio  y
y  .
.
b) La presión total necesaria para que, a esa temperatura, el 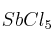 se disocie en un 60
se disocie en un 60 .
.
Datos: 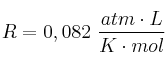
-
Equilibrio heterogéneo sólido-gas 0001
En un recipiente de 2L se introduce una cierta cantidad de 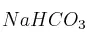 , se extrae el aire existente en el mismo, se cierra y se calienta a 400 ºC, produciéndose la reacción de descomposición siguiente:
, se extrae el aire existente en el mismo, se cierra y se calienta a 400 ºC, produciéndose la reacción de descomposición siguiente:
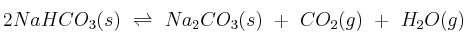
Una vez alcanzado el equilibrio, la presión dentro del recipiente es 0,962 atm. Calcula:
a) La constante de equilibrio  de esa reacción.
de esa reacción.
b) La cantidad de 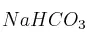 que se ha descompuesto, expresada en moles en gramos.
que se ha descompuesto, expresada en moles en gramos.
Masas atómicas: H = 1 ; C = 12 ; O = 16 ; Na = 23
 Constante equilibrio
Constante equilibrio