-
Problema neutralización ácido-base 0006
A temperatura ambiente, la densidad de una disolución de ácido sulfúrico del 24 de riqueza en peso es de 1,17 g/mL. Calcula:
de riqueza en peso es de 1,17 g/mL. Calcula:
a) Su concentración molar.
b) El volumen de disolución necesario para neutralizar 100 mL de disolución 2,5 M de hidróxido potásico.
Datos: H = 1 ; S = 32 ; O = 16
-
Equilibrio químico: Principio de Le Chatelier 0001
En condiciones estándar la descomposición del dióxido de nitrógeno es endotérmica. Responde razonadamente a las siguientes cuestiones:
a) ¿Variará la constante de equilibrio si se aumenta la concentración de oxígeno en el equilibrio?
b) ¿Será iguales los valores de  y
y  en esas condiciones?
en esas condiciones?
c) ¿Hacia dónde evoluciona el equilibrio si se produce un descenso en la presión del sistema?
-
Verdadero o falso sobre cinética química y velocidad de reacción (1396)
Explica si son verdaderas o falsas las siguientes afirmaciones:
a) El modelo de colisiones define un estado de transición de elevada energía que no se ve afectado por factores como la temperatura del sistema.
b) La velocidad de un proceso químico es independiente del estado de agregación de los reactivos.
c) Los catalizadores positivos aumentan la velocidad de reacción afectando a la energía de activación del complejo activado.
-
Reacciones orgánicas comunes 0002
Completa las siguientes reacciones indicando qué tipo de reacción se produce, nombrando los productos que se obtienen y señalando cuáles son los mayoritarios en el caso de que se produzcan varios productos:
a) 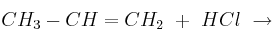
b) 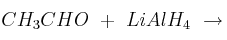
c) 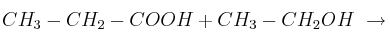
-
Configuración electrónica y estados de oxidación 0001
Escribe la configuración electrónica externa de los elementos Z = 16 (A) y Z = 20 (B), deduce cuáles será sus estados de oxidación más probables, el tipo de compuesto que formarán entre sí, la fórmula empírica y las propiedades físicas esperadas.
 RESUELTO
RESUELTO