-
EBAU Andalucía: química (junio 2011) - ejercicio A.3 (1461)
Al calentar yodo en una atmósfera de dióxido de carbono, se produce monóxido de carbono y pentaóxido de diyodo:
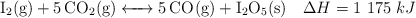
Justifica el efecto que tendrán los cambios que se proponen:
a) Disminución del volumen sobre el valor de la constante  .
.
b) Adición de 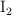 sobre la cantidad de CO.
sobre la cantidad de CO.
c) Reducción de la temperatura sobre la cantidad de  .
.
-
Equilibrio químico: Kp y presiones parciales 0001
Para la reacción: 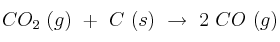 ,
,  = 10 a la temperatura de 815 ºC. Calcule, en el equilibrio:
= 10 a la temperatura de 815 ºC. Calcule, en el equilibrio:
a) Las presiones parciales de  y CO a esa temperatura, cuando la presión total en el reactor es de 2 atm.
y CO a esa temperatura, cuando la presión total en el reactor es de 2 atm.
b) El número de moles de  y de CO, si el volumen del reactor es de 3 litros.
y de CO, si el volumen del reactor es de 3 litros.
-
Equilibrio químico: Constante de equilibrio y grado disociación 0001
En un matraz de 2 litros se introducen 12 g de pentacloruro de fósforo y se calienta hasta 300 ºC. Al establecerse el equilibrio de disociación, a esta temperatura:
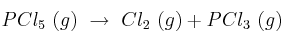
la presión total de la mezcla es de 2,12 atm.
a) ¿Cuánto vale el grado de disociación en las condiciones señaladas?
b) ¿Cuál es el valor de Kp a esa temperatura?
Masas atómicas: P = 31; Cl = 35,5.
-
Equilibrio químico: Constantes de equilibrio Kc y Kp 0001
Una mezcla de 2,5 moles de nitrógeno y 2,5 moles de hidrógeno se coloca en un reactor de 25 L y se calienta a 400 ºC. En el equilibrio ha reaccionado el 5  del nitrógeno. Calcula:
del nitrógeno. Calcula:
a) Los valores de las constantes de equilibrio  y
y  a 400 ºC, para la reacción
a 400 ºC, para la reacción 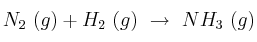
b) Las presiones parciales de los gases en el equilibrio.
-
Equilibrio químico: Principio de Le Chatelier 0001
En condiciones estándar la descomposición del dióxido de nitrógeno es endotérmica. Responde razonadamente a las siguientes cuestiones:
a) ¿Variará la constante de equilibrio si se aumenta la concentración de oxígeno en el equilibrio?
b) ¿Será iguales los valores de  y
y  en esas condiciones?
en esas condiciones?
c) ¿Hacia dónde evoluciona el equilibrio si se produce un descenso en la presión del sistema?
 Constante equilibrio
Constante equilibrio