-
PAU equilibrio químico 0014
El  reacciona con el
reacciona con el 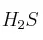 a altas temperaturas según:
a altas temperaturas según:
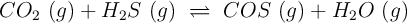
Se introducen 4,4 g de  en un recipiente de 2,5 litros, a 337 ºC, y una cantidad suficiente de
en un recipiente de 2,5 litros, a 337 ºC, y una cantidad suficiente de 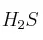 para que, una vez alcanzado el equilibrio, la presión total sea 10 atm. En la mezcla en equilibrio hay 0,01 mol de agua. Calcula:
para que, una vez alcanzado el equilibrio, la presión total sea 10 atm. En la mezcla en equilibrio hay 0,01 mol de agua. Calcula:
a) El número de moles de cada una de las especies en equilibrio.
b) El valor de las constantes  y
y  a esa temperatura.
a esa temperatura.
Datos: C = 12; O = 16; 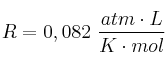
-
PAU equilibrio químico 0013
Considera el siguiente sistema en equilibrio:
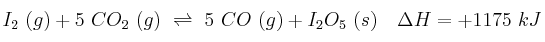
Justifica el efecto que tendrá, sobre el parámetro que se indica, el cambio que se propone:
a) Aumento de la temperatura (sobre el valor de  ).
).
b) Adición de 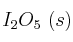 (sobre la cantidad de
(sobre la cantidad de 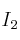 ).
).
c) Aumento de la presión (sobre la cantidad de CO).
-
Cuestión ácido-base 0024
Escribe la reacción entre el ácido sulfhídrico y el ión carbonato. Calcula la constante de equilibrio,  , de dicha reacción. Predice en qué sentido estará desplazado el equilibrio.
, de dicha reacción. Predice en qué sentido estará desplazado el equilibrio.
Datos: 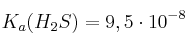 ;
; 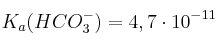
-
Problema ácido-base 0009
Razona en qué sentido está desplazado el equilibrio:
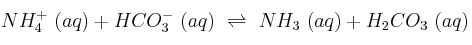
Datos: 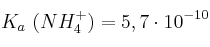 ;
; 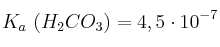
-
PAU equilibrio químico 0012
A la temperatura de 400 ºC y 710 mm Hg de presión, el amoniaco se encuentra disociado en un 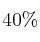 según la ecuación:
según la ecuación:
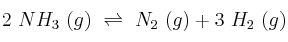
Calcula:
a) La presión parcial de cada uno de los gases que constituyen la mezcla en equilibrio.
b) El valor de las constantes  y
y  a esas temperaturas.
a esas temperaturas.
(Dato: 1 atm = 760 mm Hg)
 Constante equilibrio
Constante equilibrio