-
Volumen de disolución de nitrato de plata para valorar una cantidad de cloruro de magnesio
¿Cuántos mL de de solución de nitrato de plata 0.120 N (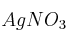 ) se requieren para titular directamente el cloruro en una solución de 0.220 g de
) se requieren para titular directamente el cloruro en una solución de 0.220 g de 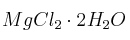 . Escribe la reacción de valoración.
. Escribe la reacción de valoración.
Masas atómicas: Mg = 24.3 ; Ag = 107.8 ; Cl = 35.5 ; N = 14 ; O = 16.
-
Repaso: reacción ajustada entre nitrito de sodio y cloruro de amonio
Escribe la ecuación química balanceada entre el nitrito de sodio y el cloruro de amonio sobre agua destilada, calentando posteriormente.
-
Ampliación: volumen de óxido de dinitrógeno que se obtiene de la descomposición del nitrato de amonio
El nitrato de amonio, por acción del calor, se descompone en nitrógeno y agua. Calcula el volumen, expresado en litros, del óxido de nitrógeno, medido a 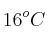 y 752 mm Hg, que se obtiene al calentar 12 g de nitrato de amonio.
y 752 mm Hg, que se obtiene al calentar 12 g de nitrato de amonio.
Datos: N = 14 ; H = 1 ; O = 16 ; 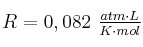
-
Rendimiento de reacción y masa de producto que se obtiene
Dada la reacción:
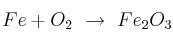
a) ¿Cuál es la masa de 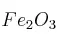 que se obtendría, con un rendimiento teórico del
que se obtendría, con un rendimiento teórico del 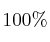 , a partir de 4,86 g de Fe con
, a partir de 4,86 g de Fe con 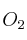 en exceso?
en exceso?
b) Si la masa que se obtiene en realidad es 6,76 g de 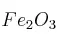 a partir de los 4,86 g de Fe, ¿cuál es el rendimiento porcentual de la reacción?
a partir de los 4,86 g de Fe, ¿cuál es el rendimiento porcentual de la reacción?
c) Bajo otras condiciones, el rendimiento porcentual del proceso es 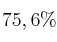 . ¿Cuántos gramos de
. ¿Cuántos gramos de 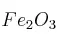 se obtienen con 4,86 g Fe en esas condiciones?
se obtienen con 4,86 g Fe en esas condiciones?
Masas atómicas: Fe = 56 ; O = 16.
-
Masas mínimas de reactivos para obtener una masa de producto cuando el rendimiento es menor del 100%
Dada la siguiente ecuación química:
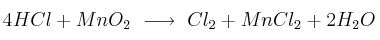
Calcula el volumen mínimo de solución de HCl al  (m/V) y la cantidad mínima de
(m/V) y la cantidad mínima de 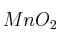 que se deberá poner en contacto si se desean producir 63 g de cloruro de manganeso, siendo el rendimiento de la reacción el
que se deberá poner en contacto si se desean producir 63 g de cloruro de manganeso, siendo el rendimiento de la reacción el 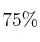 .
.
Datos: Mn = 55 ; Cl = 35,5 ; H = 1 ; O = 16.
 Reacciones químicas
Reacciones químicas