-
Reacciones químicas: estequiometría de la reacción de formación del dióxido de nitrógeno (800)
La reacción de formación del dióxido de nitrógeno es:
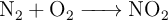
Si se hacen reaccionar 12 L de  (1 atm y
(1 atm y 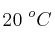 ) con exceso de nitrógeno:
) con exceso de nitrógeno:
a) ¿Cuántos moles de 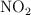 se obtendrán?
se obtendrán?
b) ¿Cuántos átomos de nitrógeno contienen?
c) ¿Cuántos átomos de oxígeno?
-
Cantidad de oxígeno y volumen de hidrógeno al descomponer agua (799)
El agua se puede descomponer en hidrógeno, 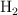 , y oxígeno,
, y oxígeno, 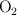 . Si tratamos 300 g de agua en una cuba electrolítica, ¿qué cantidad de oxígeno se obtendrá? ¿Qué volumen de hidrógeno se obtendrá, medido en condiciones normales?
. Si tratamos 300 g de agua en una cuba electrolítica, ¿qué cantidad de oxígeno se obtendrá? ¿Qué volumen de hidrógeno se obtendrá, medido en condiciones normales?
Masas atómicas: H = 1 ; O = 16.
-
Volumen de CO2 en condiciones normales al quemar carbón (206)
Quemamos 15 g de carbón, ¿qué volumen de  obtendremos en condiciones normales?
obtendremos en condiciones normales?
-
Relación volumétrica en la reacción de formación del amoniaco
El nitrógeno y el hidrógeno (ambos gaseosos) se combinan para formar amoniaco en una relación de volumen de 3 de hidrógeno: 1 de nitrógeno: 2 de amoniaco. A partir de 6 litros de hidrógeno gaseoso y 4 litros de nitrógeno gaseoso:
a) ¿Qué reactivo está en exceso?
b) ¿Cuántos litros de amoniaco se obtienen?
-
Estequiometría de las reacciones químicas, gases y disoluciones (106)
El cobre reacciona con ácido sulfúrico produciendo sulfato de cobre(II), dióxido de azufre y agua.
a) ¿Qué volumen de ácido sulfúrico al 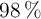 en peso y densidad 1.84 g/mL es necesario para obtener 100 L de dióxido de azufre, medidos en condiciones normales?
en peso y densidad 1.84 g/mL es necesario para obtener 100 L de dióxido de azufre, medidos en condiciones normales?
b) ¿Cuántos gramos de un mineral que contiene un 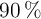 de pureza en cobre se necesitarán para obtener el volumen de dióxido de azufre anterior?
de pureza en cobre se necesitarán para obtener el volumen de dióxido de azufre anterior?
Datos: Cu = 63.5 ; S = 32 ; O = 16 ; H = 1.
 Gases
Gases