-
PAU equilibrio químico 0004
En un matraz de 2 L se introducen 12 g de pentacloruro de fósforo y se calienta hasta 300 ºC. Al establecerse el equilibrio de disociación a esta temperatura:
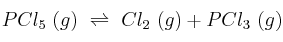
la presión total de la mezcla es 2,12 atm.
a) ¿Cuánto vale el grado de disociación en las condiciones señaladas?
b) ¿Cuál es el valor de 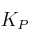 a esa temperatura?
a esa temperatura?
-
PAU equilibrio químico 0003
En un recipiente de 0,5 L, y a cierta temperatura, se introducen 10 g de 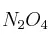 . Cuando se alcanza el equilibrio:
. Cuando se alcanza el equilibrio:
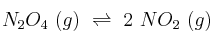
la constate 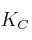 vale 0,182 M.
vale 0,182 M.
a) ¿Cuáles son las concentraciones en el equilbrio?
b) Suponiendo que la reacción es endotérmica, ¿será mayor 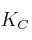 si aumentamos el valor de la temperatura del sistema? Razona tu respuesta.
si aumentamos el valor de la temperatura del sistema? Razona tu respuesta.
-
PAU equilibrio químico 0002
Una mezcla gaseosa constituida inicialmente por 3,5 moles de hidrógeno y 2,5 moles de yodo se calienta a 400 ºC, con lo que al alcanzar el equilibrio se obtienen 4,5 moles de HI, siendo el volumen del recipiente de 10 L. Calcula:
a) El valor de las constantes 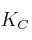 y
y 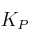 .
.
b) La concentración de los compuestos si el volumen se reduce a la mitad manteniendo constante la temperatura de 400 ºC.
-
PAU equilibrio químico 0001
Se colocan 1,5 moles de 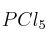 (g) en un recipiente de 3 L. Cuando se alcanza el equilibrio, a 396 K y 25,6 atm, el pentacloruro de fósforo se ha disociado en un
(g) en un recipiente de 3 L. Cuando se alcanza el equilibrio, a 396 K y 25,6 atm, el pentacloruro de fósforo se ha disociado en un  en tricloruro de fósforo (g) y
en tricloruro de fósforo (g) y 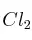 (g). Calcula:
(g). Calcula: 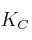 y
y 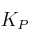 .
.
-
Cuestión equilibrio químico 0013
Considera este proceso en equilibrio a 800 ºC:
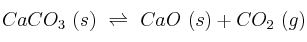
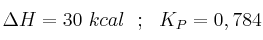
a) ¿Se puede descomponer cualquier cantidad de carbonato de calcio en un recipiente cerrado a 800 ºC?
b) Indica, razonadamente, cuáles de las siguientes medidas favorecen la descomposición de una cantidad determinada de carbonato de calcio:
– Añadir dióxido de carbono.
– Aumentar el volumen del recipiente.
– Aumentar la temperatura del sistema.
 Constante equilibrio
Constante equilibrio