-
Reacción entre el aluminio y el ácido clorhídrico (105)
El aluminio reacciona con el ácido clorhídrico dando cloruro de aluminio e hidrógeno. Se hacen reaccionar 100 g de una muestra de aluminio del 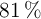 de pureza con ácido clorhídrico. Calcula:
de pureza con ácido clorhídrico. Calcula:
a) El volumen de disolución del ácido clorhídrico 5 M necesario para la reacción.
b) El volumen de hidrógeno gaseoso obtenido medido a 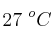 y 740 mm Hg.
y 740 mm Hg.
Datos: Al = 27 ; Cl = 35.45 ; H = 1.
-
Volumen y moéculas de oxígeno que se obtienen al descomponer KClO3 impuro (100)
El clorato de potasio se descompone por el calor en cloruro de potasio y oxígeno molecular. ¿Qué volumen de oxígeno, a 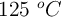 y una atmósfera de presión, puede obtenerse por descomposición de 148 g de una muestra que contiene el
y una atmósfera de presión, puede obtenerse por descomposición de 148 g de una muestra que contiene el 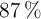 en peso de clorato potásico? ¿Cuántas moléculas de oxígeno se formarán?
en peso de clorato potásico? ¿Cuántas moléculas de oxígeno se formarán?
Datos: Cl = 35.45 ; O = 16 ; K = 39.1
-
Cantidad de SO2 y volumen de aire al tostar pirita (99)
En la tostación de la pirita:
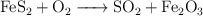
determina:
a) La cantidad de  que se obtiene al tostar 2 toneladas de pirita de un
que se obtiene al tostar 2 toneladas de pirita de un 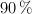 de riqueza, si el resto es ganga silícica.
de riqueza, si el resto es ganga silícica.
b) El volumen de aire, medido a 298.15 K y 1 atm de presión, que se necesita para tostar dicha cantidad de mineral. (El porcentaje de 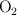 en el aire es del
en el aire es del 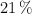 ).
).
Datos: Fe = 55.85 ; S = 32 ; O = 16
-
Relación másica de la reacción química entre el SO2 y el O2 para dar SO3 (98)
El dióxido de azufre reacciona con oxígeno gaseoso para formar trióxido de azufre.
a) ¿Cuántos gramos de trióxido de azufre podrán prepararse a partir de 23.5 g de dióxido de azufre?
b) ¿Qué volumen de oxígeno, medido en condiciones normales, se necesita para que reaccione todo el dióxido de azufre?
Datos: S = 32 ; O = 16
-
Volumen de SO2 en condiciones normales para una reacción redox (15)
El 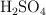 reacciona con el
reacciona con el  según el proceso:
según el proceso:
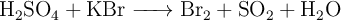
¿Cuántos litros de 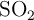 , en condiciones normales, se obtienen a partir de 50 g de
, en condiciones normales, se obtienen a partir de 50 g de  ?
?
(Datos: K = 39 ; Br = 80)
 Gases
Gases