-
Problema equilibrio químico 0014
En un recipiente vacío se introduce 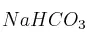 sólido. Se cierra y se calienta a 120 ºC. Cuando se alcanza el equilibrio, la presión es de 1720 mm de Hg.
sólido. Se cierra y se calienta a 120 ºC. Cuando se alcanza el equilibrio, la presión es de 1720 mm de Hg.
Calcula, a dicha temperatura,  y
y  para el proceso:
para el proceso:
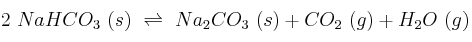
-
Problema equilibrio químico 0012
Para la reacción de descomposición del cloruro de amonio sólido:
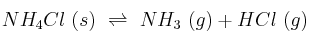
la constante de equilibrio,  , es
, es 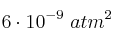 , a 400 K.
, a 400 K.
Calcula las presiones parciales de amoniaco y de cloruro de hidrógeno, producidos en la descomposición de una muestra de cloruro de amonio sólido, a 400 K, una vez alcanzado el equilibrio.
-
Problema equilibrio químico 0011
Cuando se mezclan 0,40 moles de gas xenón con 0,80 moles de gas flúor, en un recipiente de 2 litros a cierta temperatura, se observa que el 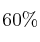 del xenón reacciona con el flúor formándose
del xenón reacciona con el flúor formándose 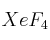 gaseoso.
gaseoso.
a) Calcula, a esa temperatura,  para la reacción:
para la reacción:
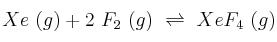
b) ¿Cuántos moles de 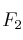 se deben añadir para que la conversión sea del
se deben añadir para que la conversión sea del 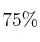 ?
?
-
Problema equilibrio químico 0010
A 1200 ºC, la constante de equilibrio para la reacción:
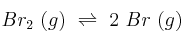
es 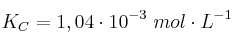 . Si la concentración inicial de bromo molecular es 1 M:
. Si la concentración inicial de bromo molecular es 1 M:
a) Calcula la concentración de bromo atómico en el equilibrio.
b) ¿Qué fracción de 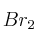 se encuentra disociada en átomos de bromo?
se encuentra disociada en átomos de bromo?
-
Problema equilibrio químico 0009
A 375 K, la constante  de la reacción:
de la reacción:
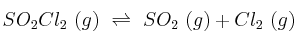
vale 2,4 atm. Supón que se colocan 6,7 g de 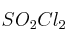 en un matraz de un litro a la temperatura de 375 K. ¿Cuáles serán las presiones parciales de cada uno de los gases cuando se alcance el equilibrio químico?
en un matraz de un litro a la temperatura de 375 K. ¿Cuáles serán las presiones parciales de cada uno de los gases cuando se alcance el equilibrio químico?
 Constante equilibrio
Constante equilibrio