-
Ley de las proporciones definidas en la reacción entre nitrógeno y níquel (7985)
El níquel y el nitrógeno se combinan en la proporción 5:3 para formar el nitruro de níquel(II). Si se hacen reaccionar 60 g de Ni con 40 g de N, determina:
a) El elemento que sobra y el elemento que se consume totalmente tras la reacción, así como la cantidad que sobra y la cantidad necesaria del otro elemento para que no sobrase nada.
b) Cantidad de nitruro de níquel(II) que se forma.
c) Representa la ecuación química del proceso.
-
Volumen de disolución de ácido sulfúrico necesario para una reacción (7950)
Dada la reacción:
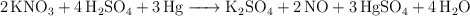
Si se colocan en el recipiente de la reacción 7.0 g de una muestra mineral, que contiene un 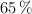 en masa de
en masa de 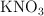 , con 17 g de mercurio y acido sulfúrico 12 M, de densidad
, con 17 g de mercurio y acido sulfúrico 12 M, de densidad 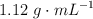 . Calcula el volumen mínimo de acido sulfúrico que será necesario emplear.
. Calcula el volumen mínimo de acido sulfúrico que será necesario emplear.
Masas atómicas: K = 39 ; N = 14 ; O = 16 ; Hg = 200.6 ; S = 32 ; H = 1.
-
Masa de agua que se obtiene al reaccionar volúmenes de oxígeno e hidrógeno (7852)
El hidrógeno y el oxígeno gaseosos reaccionan, en condiciones adecuadas, dando agua líquida. Si se hacen reaccionar 10 L de 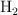 con 3.5 L de
con 3.5 L de  medidos en condiciones normales, ¿qué masa de agua se obtendrá?
medidos en condiciones normales, ¿qué masa de agua se obtendrá?
Masas atómicas: H = 1 ; O = 16.
-
Reactivo limitante y rendimientos de una reacción de neutralización (7228)
Se hacen reaccionar 45.3 g de 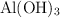 con 123.42 g de
con 123.42 g de 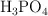 . Si se forman 62.45 g de
. Si se forman 62.45 g de 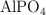 , escribe la ecuación ajustada y determina:
, escribe la ecuación ajustada y determina:
a) El reactivo limitante.
b) El rendimiento teórico de la reacción.
c) El rendimiento práctico de la reacción.
d) El porcentaje del rendimiento.
Masas atómicas: Al = 27 ; O = 16 ; H = 1 ; P = 31
-
Reactivo limitante, masa de urea y masa de reactivo excedente (7109)
La urea se prepara según la siguiente reacción:
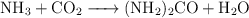
se hacen reaccionar 637.3 g de 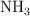 con 1 141 g de
con 1 141 g de  , calcula:
, calcula:
a) El reactivo limitante.
b) La masa de 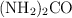 formada.
formada.
c) La cantidad del reactivo excedente en gramos al finalizar la reacción.
 Reactivo limitante
Reactivo limitante