-
PAU Andalucía: química (junio 2025) - pregunta 2 - ejercicio 2B (8478)
La reacción química 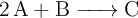 tiene como ecuación de velocidad
tiene como ecuación de velocidad ![v= k\cdot [A]^2\cdot [B] v= k\cdot [A]^2\cdot [B]](local/cache-TeX/054a83c6a1d414352e371e7095e78727.png) . Responde razonadamente:
. Responde razonadamente:
a) ¿Cuál es el orden total de la reacción?
b) Determina las unidades de la constante de velocidad.
c) ¿Se puede considerar que, durante el transcurso de la reacción química, la velocidad de la reacción permanece constante?
d) ¿La velocidad de desaparición de B es igual que la velocidad de aparición de C?
-
Constante de velocidad y tiempo de vida media para una reacción de primer grado (8459)
Se ha estudiado la descomposición del compuesto «A» en productos a una temperatura constante de 298 K. La reacción es de primer orden respecto a «A». A continuación, se proporcionan los datos experimentales de la concentración de «[A]» en función del tiempo:
![\begin{tabular}{| c | c |} \hline tiempo\ (s) & [A]\ (\text{mol}\cdot L^{-1}) \\\hline 0&1.000\\\hline 50&0.607\\\hline 100&0.368\\\hline 200&0.135\\\hline 300&0.050\\\hline \end{tabular} \begin{tabular}{| c | c |} \hline tiempo\ (s) & [A]\ (\text{mol}\cdot L^{-1}) \\\hline 0&1.000\\\hline 50&0.607\\\hline 100&0.368\\\hline 200&0.135\\\hline 300&0.050\\\hline \end{tabular}](local/cache-TeX/3d221adca24eb6004ced5083ef82c57a.png)
Determina la constante de velocidad de la reacción «k», utilizando la regresión lineal como método gráfico, y el tiempo de vida media de la reacción.
-
Estudio de la cinética química de una reacción elemental de orden 3 (8435)
Se estudia la cinética de la reacción química:
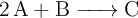
La reacción es de tercer orden, siendo 2 el orden parcial de «A» y 1 el orden parcial de «B». A una temperatura constante de 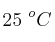 , se midieron las concentraciones de «A» y «B» en función del tiempo, obteniéndose los siguientes datos:
, se midieron las concentraciones de «A» y «B» en función del tiempo, obteniéndose los siguientes datos:
![\begin{tabular}{|c|c|c|} \hline \tex{tiempo (s)} & \text{[A] (M)} & \text{[B] (M)}\\ \hline 0 & 0.500 & 0.300\\ \hline 100 & 0.400 & 0.250\\ \hline 200 & 0.320 & 0.210\\ \hline 300 & 0.256 & 0.176\\ \hline 400 & 0.205 & 0.148\\ \hline \end{tabular} \begin{tabular}{|c|c|c|} \hline \tex{tiempo (s)} & \text{[A] (M)} & \text{[B] (M)}\\ \hline 0 & 0.500 & 0.300\\ \hline 100 & 0.400 & 0.250\\ \hline 200 & 0.320 & 0.210\\ \hline 300 & 0.256 & 0.176\\ \hline 400 & 0.205 & 0.148\\ \hline \end{tabular}](local/cache-TeX/d5de06f019a7710d9917aef0f4c5af01.png)
a) Determina la constante de velocidad «k» de la reacción.
b) Calcula la concentración de «A» y «B» después de 500 segundos.
c) Determina el tiempo de vida media 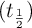 de la reacción.
de la reacción.
-
Orden de reacción y constante de velocidad en una reacción química (8398)
La siguiente reacción ocurre a 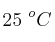 :
:

En experimentos realizados, se observó que al doblar la concentración de «A» se multiplica por ocho la velocidad de la reacción. Determina el orden de reacción con respecto a «A» y calcula la constante cinética si la velocidad inicial de la reacción es 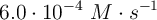 , cuando la concentración inicial de «A» es 0.050 M.
, cuando la concentración inicial de «A» es 0.050 M.
-
EBAU Andalucía: química (junio 2024) RESERVA - ejercicio B.2 (8236)
La reacción en fase gaseosa 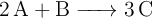 es de orden 2 respecto de A y de orden uno respecto de B.
es de orden 2 respecto de A y de orden uno respecto de B.
a) Escribe la ecuación de velocidad en función de las concentraciones de A y B e indica el orden total de reacción.
b) Indica las unidades de la velocidad de reacción y de la constante cinética para esta reacción.
c) Razona cómo afectará a la velocidad de reacción un aumento de la temperatura a volumen constante.
 Constante velocidad
Constante velocidad