-
Relación másica en la neutralización de un ácido y una base (7004)
La reacción de neutralización entre el ácido clorhídrico y el cinc, en medio acuoso, produce cloruro de cinc e hidrógeno gaseoso. Si tras la reacción se recogen 12.5 L de hidrógeno, medidos en condiciones normales, calcula:
a) La masa de cada reactivo que ha reaccionado.
b) Los moles de cloruro de cinc producidos.
Masas atómicas: Zn = 65.4 ; H = 1 ; Cl = 35.5
-
Masa de cromo y moléculas de óxido de aluminio que se obtienen tras reacción (6997)
Cuando el óxido de cromo(III) reacciona con aluminio se forman el óxido de aluminio y cromo metálico. Si se hacen reaccionar 125 g de óxido de cromo(III) con exceso de aluminio:
a) ¿Qué masa de cromo se obtiene?
b) ¿Cuántas moléculas de óxido de aluminio se formarán al final de la reacción?
Datos: Al = 27 ; O = 16 ; Cr = 52 ; 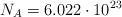 .
.
-
Masas de productos al hacer reaccionar sulfato de sodio con cloruro de bario (6986)
Se hacen reaccionar 125 g de sulfato de sodio (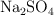 ) con un exceso de cloruro de bario. Calcula las masas de cloruro de sodio y de sulfato de bario (
) con un exceso de cloruro de bario. Calcula las masas de cloruro de sodio y de sulfato de bario (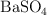 ) que se producen. La reacción tiene lugar en disolución acuosa.
) que se producen. La reacción tiene lugar en disolución acuosa.
Masas atómicas: Ba = 137.3 ; Cl = 35.5 ; S = 32 ; O = 16 ; Na = 23.
-
Volumen de nitrógeno e hidrógeno que se obtiene al descomponer una masa de amoniaco (6989)
El gas amoniaco se descompone dando gas nitrógeno y gas hidrógeno:
a) Escribe y ajusta la reacción.
b) En un recipiente se introducen 34 g de amoniaco a 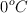 y 1 atm. ¿Qué volumen de nitrógeno e hidrógeno se obtendrá en esas mismas condiciones?
y 1 atm. ¿Qué volumen de nitrógeno e hidrógeno se obtendrá en esas mismas condiciones?
(Masas atómicas: N= 14 ; H = 1)
-
Volumen de oxígeno y dióxido de azufre necesario para obtener 20 L de trióxido de azufre (6988)
Durante la fabricación del ácido sulfúrico el gas dióxido de azufre se hace reaccionar con oxígeno para obtener trióxido de azufre, que también es un gas.
a) Escribe la ecuación química que tiene lugar.
b) ¿Qué volumen de dióxido de azufre y de oxígeno para obtener 20 L de trióxido de azufre, si todos los gases se encuentran en las mismas condiciones de presión y temperatura?
Masas atómicas (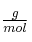 ): S = 32 ; O = 16.
): S = 32 ; O = 16.