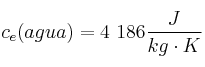Mezcla de sustancias a distinta temperatura 0002
Una esfera de acero de 400 g a una temperatura de ![]() es sumergida en 3 L de agua a una temperatura de
es sumergida en 3 L de agua a una temperatura de ![]() . ¿Cuál es la temperatura final del sistema?
. ¿Cuál es la temperatura final del sistema?
Datos: 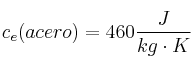 ;
; 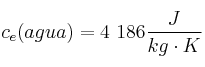
Una esfera de acero de 400 g a una temperatura de ![]() es sumergida en 3 L de agua a una temperatura de
es sumergida en 3 L de agua a una temperatura de ![]() . ¿Cuál es la temperatura final del sistema?
. ¿Cuál es la temperatura final del sistema?
Datos: 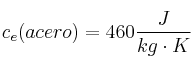 ;
;