Transferencia de calor: temperatura final de una mezcla 0001
Un pedazo de plomo de 250 g se calienta a ![]() y se echa en 500 g de agua inicialmente a
y se echa en 500 g de agua inicialmente a ![]() . Despreciando la capacidad calórica del recipiente, ¿cuál es la temperatura final del plomo y el agua?
. Despreciando la capacidad calórica del recipiente, ¿cuál es la temperatura final del plomo y el agua?
Datos: 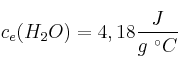 ;
; 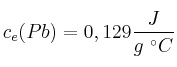
 Ejercicios FyQ
Ejercicios FyQ