A 5 mL de una disolución al ![]() en volumen de
en volumen de ![]() se añaden 2 gotas de ácido nítrico de densidad 1.4 g/mL y del
se añaden 2 gotas de ácido nítrico de densidad 1.4 g/mL y del ![]() de riqueza en peso. Calcula si serán suficientes para oxidar todo el
de riqueza en peso. Calcula si serán suficientes para oxidar todo el ![]() a
a ![]() . Considera que una gota equivale a 0.05 mL. La reacción sin ajustar que tiene lugar es:
. Considera que una gota equivale a 0.05 mL. La reacción sin ajustar que tiene lugar es:
![]()
Se tiene una celda galvánica (pila voltaica) compuesta por dos electrodos: un electrodo de cinc sumergido en una disolución de iones ![]() , con una concentración de 1.0 M, y un electrodo de plata sumergido en una disolución de iones
, con una concentración de 1.0 M, y un electrodo de plata sumergido en una disolución de iones ![]() , con una concentración de 1.0 M. Las semirreacciones que ocurren en cada electrodo son las siguientes:
, con una concentración de 1.0 M. Las semirreacciones que ocurren en cada electrodo son las siguientes:
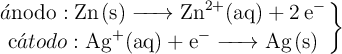
a) Escribe la reacción global de la celda galvánica.
b) Calcula el potencial estándar de la celda (![]() ) utilizando los siguientes potenciales estándar de reducción:
) utilizando los siguientes potenciales estándar de reducción: ![]() y
y ![]()
c) Calcula el potencial de la celda a ![]() utilizando la ecuación de Nernst, si la concentración de iones
utilizando la ecuación de Nernst, si la concentración de iones ![]() es 0.10 M y la concentración de iones
es 0.10 M y la concentración de iones ![]() es 0.010 M.
es 0.010 M.
d) Determina si la reacción es espontánea en las condiciones dadas.
Se construye una pila galvánica utilizando un electrodo de níquel sumergido en una disolución de ![]() 1.0 M y un electrodo de plata sumergido en una disolución de
1.0 M y un electrodo de plata sumergido en una disolución de ![]() 1.0 M, a una temperatura de 298 K.
1.0 M, a una temperatura de 298 K.
a) Escribe las semirreacciones y la reacción global de la pila, indicando cuál es el ánodo y el cátodo.
b) Calcula el potencial estándar de la pila (![]() ).
).
c) Determina la constante de equilibrio de la reacción global.
d) Si la concentración de ![]() se reduce a 0.01 M, calcula el nuevo potencial de la pila (
se reduce a 0.01 M, calcula el nuevo potencial de la pila (![]() ).
).
Datos: ![]() ;
; ![]() ;
; ![]() ;
; ![]()
a) ¿Qué peso de ![]() ha de pesarse para preparar 500 mL de disolución 0.100 N para ser utilizada como oxidante en medio ácido?
ha de pesarse para preparar 500 mL de disolución 0.100 N para ser utilizada como oxidante en medio ácido?
b) ¿Qué volumen de esta disolución se necesitaría para oxidar, en medio ácido, el Fe contenido en 10.0 mL de una disolución del ![]() en
en ![]() ?
?
c) Si la citada disolución se utiliza como oxidante en medio alcalino, ¿qué normalidad tendría?
 Ejercicios FyQ
Ejercicios FyQ