-
Fórmulas empírica y molecular de un compuesto nitrogenado (4831)
a) Un compuesto tiene un 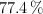 de carbono, un
de carbono, un 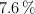 de hidrógeno y el resto de nitrógeno, ¿cuál es su fórmula empírica?
de hidrógeno y el resto de nitrógeno, ¿cuál es su fórmula empírica?
b) Si 558 g de este compuesto en estado gaseoso a  y 0.97 atm ocupan un volumen de 75.5 L, ¿cuál es su fórmula molecular?
y 0.97 atm ocupan un volumen de 75.5 L, ¿cuál es su fórmula molecular?
-
Fórmulas empírica y molecular a partir de composición centesimal (4286)
Una sustancia gaseosa contiene un 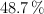 de carbono, un
de carbono, un 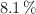 de hidrógeno y el resto de oxígeno. Si su masa molar es de 74 g/mol, determina cuáles son sus fórmulas empírica y molecular.
de hidrógeno y el resto de oxígeno. Si su masa molar es de 74 g/mol, determina cuáles son sus fórmulas empírica y molecular.
-
Fórmula molecular de un compuesto a partir de su composición (3681)
La composición en porcentaje de masa de un compuesto es de 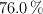 C,
C, 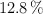 H, y
H, y 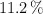 O. Si la masa molar de este compuesto es 284.5 g/mol, ¿cuál es la fórmula molecular del compuesto?
O. Si la masa molar de este compuesto es 284.5 g/mol, ¿cuál es la fórmula molecular del compuesto?
-
Fórmulas empírica y molecular de un compuesto (3617)
Una sustancia gaseosa contiene un 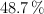 de carbono, un
de carbono, un 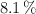 de hidrógeno y el resto de oxígeno. Si su masa molar es de 74 g/mol. Determina cuáles serán sus fórmulas empírica y molecular.
de hidrógeno y el resto de oxígeno. Si su masa molar es de 74 g/mol. Determina cuáles serán sus fórmulas empírica y molecular.
-
Relación entre masa de fósforo y átomos de wolframio (3549)
Determina el número de átomos de fósforo presentes en la masa de fosfito de wolframio(V) que contiene 0.025 g de wolframio.
 Fórmula molecular
Fórmula molecular