-
Concentraciones en el equilibrio de todas las especies en una disolución de ácido clórico (5107)
En condiciones ambientales normales, 1 atm y 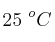 , se tiene 1 litro de agua (
, se tiene 1 litro de agua (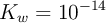 ), de densidad 1 g/mL. Se le agregan 3 moles de ácido clórico, considerando que no varía el volumen, con (
), de densidad 1 g/mL. Se le agregan 3 moles de ácido clórico, considerando que no varía el volumen, con (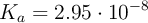 ). Considerando que la concentración de los protones en el sistema depende significativamente del ácido, es decir, ignorando lo que el agua pueda o no aportar, calcula las concentraciones molares de todas las especies:
). Considerando que la concentración de los protones en el sistema depende significativamente del ácido, es decir, ignorando lo que el agua pueda o no aportar, calcula las concentraciones molares de todas las especies: 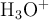 ,
, 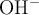 ,
, 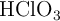 y
y 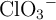 .
.
-
pH de disolución de acético al variar su concentración 0001
Calcula el pH de una disolución de 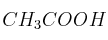 0,2 M a 25 ºC si su
0,2 M a 25 ºC si su 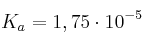 . ¿Cuál será el pH si se adiciona 1 g de
. ¿Cuál será el pH si se adiciona 1 g de 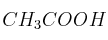 a 500 mL de esta disolución?
a 500 mL de esta disolución?
-
Concentración de especies en el equilibrio de disociación del ácido nitroso (2602)
Si tiene una disolución de ácido nitroso (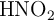 ), cuya concentración inicial es 0.003 M y la constante de disociación es igual a
), cuya concentración inicial es 0.003 M y la constante de disociación es igual a 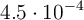 , ¿cuál será la concentración de las especies en el equilibrio?
, ¿cuál será la concentración de las especies en el equilibrio?
-
Fuerza relativa de los ácidos y constantes de disociación (2174)
a) ¿En qué se diferencian los ácidos fuertes de los débiles?
b) ¿Qué relación hay entre el valor de 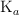 y la fuerza de los ácidos?
y la fuerza de los ácidos?
c) ¿Cuál es la propiedad más importante de una solución reguladora?
d) ¿Qué sustancias se necesitan para obtener una solución reguladora?
-
pH y pOH de una disolución de ácido acético (2131)
Calcula el pH y el pOH de una disolución de ácido acético 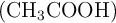 de concentración 0.001 mol/L, sabiendo que su
de concentración 0.001 mol/L, sabiendo que su 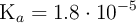
 Constante acidez
Constante acidez