-
Ley de Hess para calcular la entalpía de formación del metano (455)
Determina la entalpía de formación del metano, sabiendo que 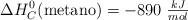 .
.
Datos: ![\Delta H_f^0 [\ce{CO2(g)}] = -393.5\ \textstyle{kJ\over mol} \Delta H_f^0 [\ce{CO2(g)}] = -393.5\ \textstyle{kJ\over mol}](local/cache-TeX/b8addf7a760f88098e19216020fb95cc.png) ;
; ![\Delta H_f^0 [\ce{H2O(l)}] = -285.8\ \textstyle{kJ\over mol} \Delta H_f^0 [\ce{H2O(l)}] = -285.8\ \textstyle{kJ\over mol}](local/cache-TeX/e642741210802c982e1f7aac50b17297.png)
-
Aplicación de la ley de Hess en la evaporación del agua (454)
Dadas las siguientes ecuaciones termoquímicas:
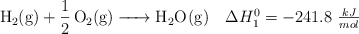
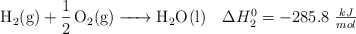
Calcula la entalpía de vaporización del agua en condiciones estándar.
-
Ley de Hess para obtener la entalpía de formación de la sacarosa (273)
La entalpía de combustión de la sacarosa (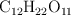 ) es
) es 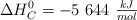 . Calcula su entalpía de formación a partir de los siguientes datos:
. Calcula su entalpía de formación a partir de los siguientes datos:
![\Delta H_f^0[\ce{CO2(g)}] = -393.5\ \textstyle{kJ\over mol} \Delta H_f^0[\ce{CO2(g)}] = -393.5\ \textstyle{kJ\over mol}](local/cache-TeX/f29ba749234bd7fb092e329e1d01a34d.png) ;
; ![\Delta H_f^0[\ce{H2O(l)}] = -285.8\ \textstyle{kJ\over mol} \Delta H_f^0[\ce{H2O(l)}] = -285.8\ \textstyle{kJ\over mol}](local/cache-TeX/1ba37a1e30e17670c75bc644177e943f.png)
-
Problema ley de Hess (265)
Los calores de combustión del 1,3-butadieno (g), el hidrógeno (g) y el butano (g) son, respectivamente: -2540 ; -285,8 y -2880 kJ/mol. Con estos datos, calcula la variación de entalpía de reacción para el proceso:
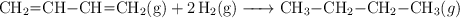
-
Ley de Hess: entalpía de formación del etino (264)
Calcula la entalpía de formación estándar del etino sabiendo que las entalpías de combustión del carbono(s), hidrógeno(g) y etino(g) son, respectivamente: -393.5, -285.8 y -1 300 kJ/mol.
 Ley de Hess
Ley de Hess