-
Ley cinética y constante de velocidad (2623)
La ley cinética de una reacción es ![v =k[A]^2 v =k[A]^2](local/cache-TeX/8fd5f91e9d6d2eaa1ed8f81761c19430.png) , para una reacción química simple. Si la velocidad fue de
, para una reacción química simple. Si la velocidad fue de 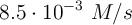 cuando [A] era 0.2 M, ¿cuál será [A] si la velocidad es
cuando [A] era 0.2 M, ¿cuál será [A] si la velocidad es  ?
?
-
Selectividad junio 2013: ecuación cinética, orden y velocidad de reacción (2158)
Para la reacción:
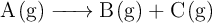
el valor de la constante de velocidad a una cierta temperatura es 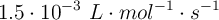 .
.
a) ¿Cuál es el orden de la reacción?
b) ¿Cuál es la ecuación de velocidad?
c) A esa misma temperatura, ¿cuál será la velocidad de la reacción cuando la concentración de A sea 0.242 M?
-
Cuestión cinética química 0010
La reacción 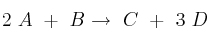 es un proceso elemental.
es un proceso elemental.
a) ¿Cuáles son los órdenes parciales y el orden total de reacción?
b) ¿Cuál es su ecuación cinética?
c) ¿Y su molecularidad?
d) Calcula la constante de velocidad si para concentraciones iniciales de A y B 0,1 M se ha obtenido un valor de la velocidad de 0,012 M/s.
-
Cuestión cinética química 0007
La velocidad de reacción del proceso 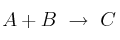 sigue la ecuación:
sigue la ecuación:
![v = k\ [A]^2[B] v = k\ [A]^2[B]](local/cache-TeX/13aec6ce51ed0e664884a61f239e742e.png)
A partir de estos datos responde a las siguientes cuestiones:
a) Indica el orden parcial de cada reactivo y el orden total de la reacción.
b) ¿Es un proceso bimolecular?
c) Si aumentamos la temperatura del sistema, ¿afectaría a esta reacción?
d) Si duplicamos la concentración inicial de A, ¿cómo variará la velocidad del proceso? ¿Y si triplicamos la concentración inicial de B?
-
PAU cinética química 0007
En la reacción 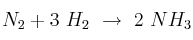 , el nitrógeno está reaccionando con una velocidad de 0,4 moles/minuto.
, el nitrógeno está reaccionando con una velocidad de 0,4 moles/minuto.
a) ¿A qué velocidad está reaccionando el hidrógeno? ¿Con qué velocidad se está formando el amoniaco?
b) ¿Con esos valores sería posible proponer valores adecuados para los exponentes 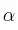 y
y 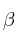 de la ecuación
de la ecuación ![v = k\ [N_2]^{\alpha}[H_2]^{\beta} v = k\ [N_2]^{\alpha}[H_2]^{\beta}](local/cache-TeX/fa2bc674a1ae8a9108ca814eb6f03ee5.png) o se necesitan más datos?
o se necesitan más datos?
 Ecuación velocidad
Ecuación velocidad