-
Reacción entre el sulfano y el hidróxido de sodio (901)
Reaccionan 17 g de 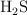 con
con 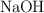 y se forman 39 g de
y se forman 39 g de  . Sabiendo que la reacción es:
. Sabiendo que la reacción es:

Calcula:
a) La masa de hidróxido de sodio (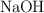 ) que ha reaccionado.
) que ha reaccionado.
b) La masa de agua 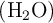 que se produce.
que se produce.
c) El número de moléculas de  formado.
formado.
-
Estequiometría de la reacción de descomposición del ácido nítrico (872)
El ácido nítrico se descompone, por acción de la luz, en dióxido de nitrógeno, oxígeno (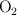 ) y agua. Si se obtienen 40.5 g de agua en la descomposición:
) y agua. Si se obtienen 40.5 g de agua en la descomposición:
a) ¿Qué cantidad de ácido habrá reaccionado?
b) ¿Cuántos moles de dióxido de nitrógeno y oxígeno se obtienen?
c) ¿Qué volumen ocupa la mezcla de gases anterior en condiciones estándar (1 atm y 298 K)?
-
Reacción de oxidación del dióxido de azufre (841)
El dióxido de azufre ( ) se oxida con el oxígeno del aire para formar el trióxido de azufre (
) se oxida con el oxígeno del aire para formar el trióxido de azufre (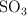 ). Suponiendo que la reacción tiene lugar en condiciones estándar (1 atm y 298 K), ¿qué volumen de
). Suponiendo que la reacción tiene lugar en condiciones estándar (1 atm y 298 K), ¿qué volumen de 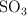 se obtendría si reaccionan 2.5 kg de
se obtendría si reaccionan 2.5 kg de  con exceso de oxígeno?
con exceso de oxígeno?
Datos: S = 32 ; O = 16.
-
Descomposición térmica del clorato de potasio (840)
El clorato potásico se descompone térmicamente según la reacción:
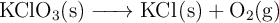
Si se calientan 15 g de 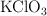 . Calcula:
. Calcula:
a) ¿Qué masa de KCl se obtendrá?
b) ¿Qué masa de oxígeno,  ?
?
c) ¿Qué volumen de oxígeno, medido en condiciones normales?
(Datos: K = 39 ; Cl = 35.5 ; O = 16)
-
Reacciones químicas: estequiometría de la reacción de formación del dióxido de nitrógeno (800)
La reacción de formación del dióxido de nitrógeno es:
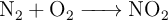
Si se hacen reaccionar 12 L de  (1 atm y
(1 atm y 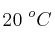 ) con exceso de nitrógeno:
) con exceso de nitrógeno:
a) ¿Cuántos moles de 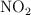 se obtendrán?
se obtendrán?
b) ¿Cuántos átomos de nitrógeno contienen?
c) ¿Cuántos átomos de oxígeno?
 Mol
Mol