-
Selectividad septiembre 2012: Mol, moléculas y masa molecular 0001
Un litro de  se encuentra en condiciones normales. Calcula:
se encuentra en condiciones normales. Calcula:
a) El número de moles que contiene.
b) El número de moléculas de  presentes.
presentes.
c) La masa en gramos de una molécula de  .
.
Masas atómicas: C=12; O=16.
-
Masa atómica, masa molecular y mol 0001
Define los siguientes conceptos:
a) Masa atómica de un elemento.
b) Masa molecular.
c) Mol.
-
Moles, moléculas y átomos 0002
Razona sin son verdaderas o falsas las siguientes afirmaciones:
a) Dos masas iguales de los elementos A y B contienen el mismo número de átomos.
b) La masa atómica de un elemento es la masa, en gramos, de un átomo de dicho elemento.
c) El número de átomos que hay en 5 g de oxígeno atómico es igual al número de moléculas que hay en 10 g de oxígeno molecular.
-
Moles, átomos y moléculas de clorometano en un volumen del gas (1836)
El clorometano, 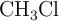 , es un gas más denso que el aire que no debe ser inhalado porque es tóxico. Si tenemos una cantidad de este gas encerrado en un recipiente de 2 L, a
, es un gas más denso que el aire que no debe ser inhalado porque es tóxico. Si tenemos una cantidad de este gas encerrado en un recipiente de 2 L, a 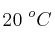 y 1 atm, determina:
y 1 atm, determina:
a) Los moles de gas que contiene el recipiente.
b) El número de moléculas que son.
c) El número de átomos de hidrógeno.
-
Moles, moléculas y átomos (1835)
En 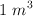 de metano (
de metano (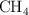 ), medido en condiciones normales de presión y temperatura, calcula:
), medido en condiciones normales de presión y temperatura, calcula:
a) El número de moles de metano.
b) El número de moléculas de metano.
c) El número de átomos de hidrógeno.
 Mol
Mol