-
Presión total de un sistema gaseoso después de una hora (4811)
El reactivo A se descompone según la reacción: 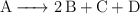 , siendo una reacción homogénena en fase gaseosa. Se tiene un mol de A en un recipiente de 2 L a
, siendo una reacción homogénena en fase gaseosa. Se tiene un mol de A en un recipiente de 2 L a 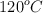 . Halla la presión total del recipiente al cabo de una hora a partir de los datos de la tabla siguiente:
. Halla la presión total del recipiente al cabo de una hora a partir de los datos de la tabla siguiente:

-
Reacción en el estómago al tomar antiácido
El estómago produce de forma natural el ácido clorhídrico que puede irritar las paredes del estómago, llegando incluso puede agravar una patología llamada úlcera gástrica. Para disminuir o evitar estos problemas se debe recurrir a la ayuda de los antiácidos conocidos como hidróxido de magnesio. ¿Cuál es la reacción química? ¿Qué tipo de reacción es? ¿Los reactantes cumplen con la ley de la conservacion de la masa? Explica tus respuestas.
-
Reacción de neutralización: carácter ácido o básico de la mezcla final (4786)
Una muestra de 250 mL de 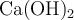 0.04 M se agregó a 15 mL de
0.04 M se agregó a 15 mL de 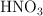 0.10 M.
0.10 M.
a) ¿La disolución resultante es básica o ácida? Razona tu respuesta.
b) ¿Cuántos moles de ácido o base quedan en exceso?
c) ¿Qué volumen de 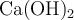 0.04 M o de
0.04 M o de 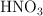 0.10 M se necesitan para neutralizar la disolución resultante.
0.10 M se necesitan para neutralizar la disolución resultante.
-
Presión final en un reactor tras la formacion de agua
Un recipiente de 1 L contiene hidrógeno gaseoso a 326 torr y 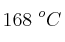 y oxígeno gaseoso a 652 torr y la misma temperatura. Se hace saltar una chispa en el seno de la mezcla a fin de que se produzca la reacción
y oxígeno gaseoso a 652 torr y la misma temperatura. Se hace saltar una chispa en el seno de la mezcla a fin de que se produzca la reacción 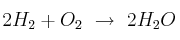 . ¿Cuál será la presión final en el recipiente si la temperatura final es
. ¿Cuál será la presión final en el recipiente si la temperatura final es 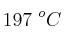 ?
?
-
Volumen de disolución e hidrógeno producido en una reacción 0001
Se tratan de 45 g de zinc con una disolución 2 M de ácido clorhídrico. Calcula el volumen de hidrógeno desprendido, medido a 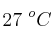 y 690 mm Hg, así como el volumen de disolución que se necesitará para ello, siendo la reacción:
y 690 mm Hg, así como el volumen de disolución que se necesitará para ello, siendo la reacción:
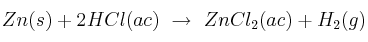
 Reacciones químicas
Reacciones químicas