-
Presión parcial de dióxido de carbono en la atmósfera de Marte
La presión atmosférica en la superficie de Marte es de aproximadamente 6.0 torr . La presión parcial del dióxido de carbono es 5.7 torr. ¿Qué porcentaje de la atmósfera marciana es dióxido de carbono?
-
Temperatura final de los gases en un cilindro tras la combustión
En el motor de un coche se comprime una mezcla de aire y gasolina en los cilindros antes de encenderse. En un motor típico se tiene una relación de compresión de 9 a 1, es decir, el gas en los cilindros se comprime a 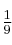 de su volumen original. La presión inicial de la mezcla es de 1 atm y la temperatura inicial es de
de su volumen original. La presión inicial de la mezcla es de 1 atm y la temperatura inicial es de 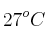 , si la presión después de la conversión es de 21.7 atm, ¿cuál es la temperatura del gas comprimido?
, si la presión después de la conversión es de 21.7 atm, ¿cuál es la temperatura del gas comprimido?
-
Leyes de los gases: Ley de Dalton (3194)
En un recipiente de 5 L se introducen 8 g de helio, 84 g de dinitrógeno y 90 g de vapor de agua. Si la temperatura del recipiente es de 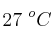 , calcula:
, calcula:
a) La presión total que ejercen los gases en las paredes del recipiente.
b) La presión que ejerce cada gas.
-
Ley general de los gases y cambios de unidades 0001
Una muestra de gas tiene un volumen de 5,10 L a 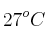 y 640 mm de Hg. Si su volumen y su temperatura cambian a 2,10 L y
y 640 mm de Hg. Si su volumen y su temperatura cambian a 2,10 L y 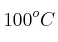 , ¿cuál será la presión? Expresa el resultado en torr, Pa, kPa, atm y mm de Hg.
, ¿cuál será la presión? Expresa el resultado en torr, Pa, kPa, atm y mm de Hg.
-
Relación estequiométrica entre reactivo y moles de gas 0001
El trinitrato de glicerilo, conocido como nitroglicerina, es un explosivo de gran potencia. Esto se debe principalmente a que su descomposición genera un gran aumento de volumen. La nitroglicerina se utiliza también como medicamento contra la angina de pecho, que es una insuficiencia transitoria del aporte de sangre, oxígeno y nutrientes al corazón, acompañada de un dolor muy intenso. Su acción es tan eficaz, que inmediatamente después de masticar una cápsula de nitroglicerina, sucede una vasodilatación coronaria que incrementa el flujo sanguíneo y mejora la irrigación al corazón. La reacción de descomposición de la nitroglicerina es:
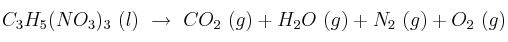
Si cada cápsula de nitroglicerina contiene 0,8 mg de ésta, ¿cuántos moles de gas se producen y qué volumen ocupan a la temperatura del cuerpo humano y la presión de 1,0 atm?
 Leyes de los gases
Leyes de los gases