-
Potenciales estándar de reducción 0002
a) ¿Reaccionará una disolución acuosa de ácido clorhídrico con hierro metálico?
b) ¿Reaccionará una disolución acuosa de ácido clorhídrico con cobre?
c) ¿Qué ocurrirá si se añaden limaduras de hierro a una disolución de 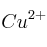 ?
?
Justifique las respuestas.
Datos: 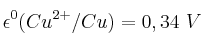 ;
; 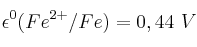 ;
; 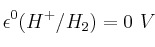
-
Electroquímica: aplicación de la ley de Faraday (1750)
En el cátodo de una cuba electrolítica se reduce la especie dicromato a catión 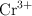 , en medio ácido. Calcula:
, en medio ácido. Calcula:
a) ¿Cuántos moles de electrones deben llegar al cátodo para reducir un mol de dicromato?
b) Para reducir toda la especie dicromato presente en 20 mL de disolución, se requiere una corriente eléctrica de 2.2 amperios durante 15 minutos. Calcula la carga que se consume, expresada en Faraday, y deduce cuál será la concentración inicial de dicromato.
Dato: F = 96 500 C.
-
EBAU Andalucía: química (junio 2011) - ejercicio B.3 (1467)
En la tabla siguiente se indican los potenciales estándar de reducción de distintos pares en disolución acuosa, expresados en voltios (V):
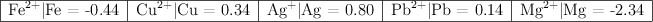
a) De estas especies, razona: ¿cuál es la más oxidante y cuál es la más reductora?
b) Si se introduce una barra de plomo en una disolución acuosa de cada una de las siguientes sales: 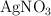 ,
, 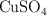 ,
, 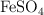 y
y 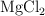 , ¿en qué casos se depositará una capa de otro metal sobre la barra de plomo? Justifica la respuesta.
, ¿en qué casos se depositará una capa de otro metal sobre la barra de plomo? Justifica la respuesta.
-
Cuestión verdadero o falso sobre pilas galvánicas y electroquímica (1422)
Razona si son verdaderas o falsas las siguientes afirmaciones:
a) El ánodo es el lugar en el que se produce la oxidación cuando hablamos de pilas galvánicas pero no es así en las cubas electrolíticas.
b) La masa de metal que se deposita en una electrodeposición es directamente proporcional al número de electrones implicados en la reducción.
c) El potencial de una pila galvánica debe ser siempre positivo.
-
Electroquímica: Electrolisis y cuba electrolítica 0001
Para cubrir de oro una pieza de joyería son necesarios 0,045 g de metal. Calcula el tiempo durante el que una corriente de 3,2 A debe estar circulando por una cuba electrolítica que contiene una disolución acuosa de cloruro de oro(III) de concentración 1,5 M.
Datos: Au = 197 ; Cl = 35,5.
 Electroquímica
Electroquímica