-
Masas de carbonato y óxido de calcio en una muestra que se quema (7361)
Una muestra de 1.727 g que contiene solamente óxido de calcio y carbonato de calcio, se quemó hasta la descomposición total del carbonato de calcio, según la ecuación:
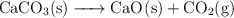
La masa del residuo que quedó después de la combustión fue 1.551 g. Calcula las masas de 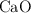 y
y 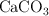 presentes en la muestra original.
presentes en la muestra original.
-
Ampliación: estequiometría, gases y composición centesimal (7360)
Se tratan 10.0 g de un mineral de aluminio que contiene una pureza del 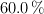 , con 50.0 mL de una solución acuosa 0.150 M de ácido sulfúrico. Los productos de esta reacción son hidrógeno gaseoso y tris-tetraoxidosulfato de dialuminio.
, con 50.0 mL de una solución acuosa 0.150 M de ácido sulfúrico. Los productos de esta reacción son hidrógeno gaseoso y tris-tetraoxidosulfato de dialuminio.
a) Escribe la ecuación química de la reacción.
b) ¿Qué volumen de hidrógeno se obtendrá, medido en condiciones normales de presión y temperatura?
c) Determina la composición centesimal del tris-tetraoxidosulfato de dialuminio.
-
Volumen de disolución de ácido sulfúrico y masa de cinc para obtener un volumen de hidrógeno (7284)
Para obtener 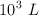 de hidrógeno, en condiciones normales, ¿qué volumen de ácido sulfúrico, de una riqueza del
de hidrógeno, en condiciones normales, ¿qué volumen de ácido sulfúrico, de una riqueza del 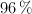 en peso y densidad de
en peso y densidad de 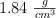 , y qué masa de cinc se necesitan?
, y qué masa de cinc se necesitan?
-
Volumen de aire para oxidar suficiente glucosa por hora en el organismo (7264)
La oxidación de la glucosa en el cuerpo se realiza de acuerdo con la reacción redox:

Si el consumo de glucosa de un organismo es de 2.77 mol/día, ¿cuál será el volumen de aire, a  y la presión de 1 bar, que debo respirar para lograr esta oxidación durante una hora?
y la presión de 1 bar, que debo respirar para lograr esta oxidación durante una hora?
-
Masa de hierro y volumen de ácido sulfúrico necesarios para obtener un volumen de hidrógeno (7243)
Se quieren obtener 10 L de 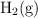 a
a 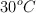 y 780 torr de presión y se dispone de hierro al
y 780 torr de presión y se dispone de hierro al 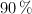 de pureza y de ácido sulfúrico 1 M. ¿Cuántos gramos de ese hierro y cuántos mililitros del ácido serán necesarios?
de pureza y de ácido sulfúrico 1 M. ¿Cuántos gramos de ese hierro y cuántos mililitros del ácido serán necesarios?
Masa atómica del hierro 56.
 Reacciones químicas
Reacciones químicas