-
Volumen específico molar de una mezcla de gases (6209)
Un tanque contiene una mezcla de gases, los cuales están en la siguiente proporción: 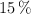 mol
mol 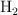 y el resto es but-1-eno. Halla el volumen específico molar si la presión de la mezcla es de 10 atm y la temperatura de
y el resto es but-1-eno. Halla el volumen específico molar si la presión de la mezcla es de 10 atm y la temperatura de 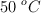 .
.
Datos: C = 12 ; H = 1 ; 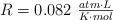
-
Cantidad de aire que sale de un neumático al abrir la válvula a T constante (6151)
El aire de un neumático de automóvil, de volumen 30 L, está a la presión de 2 atmósferas. ¿Cuánto aire saldría del neumático si se abriese la válvula? Debes suponer que el volumen del neumático no varía y la temperatura es constante.
-
Presión final de una mezcla de gases (6150)
Tres frascos de 1 L, todos a 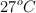 , han sido intercomunicados mediante espitas inicialmente cerradas. El primer frasco contiene 1 g de
, han sido intercomunicados mediante espitas inicialmente cerradas. El primer frasco contiene 1 g de 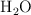 , el segundo contiene
, el segundo contiene 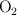 a la presión de 1 atm y el tercero 1 g de
a la presión de 1 atm y el tercero 1 g de 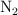 . A la temperatura de
. A la temperatura de 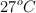 , la presión de vapor del agua es 0.038 atm. Calcula:
, la presión de vapor del agua es 0.038 atm. Calcula:
a) La presión inicial en cada frasco.
b) Si se abren las espitas y se espera a que se alcance el equilibrio, ¿cuál será la presión en el sistema?
c) Si la temperatura del sistema se eleva a 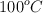 , ¿cuál será entonces la presión?
, ¿cuál será entonces la presión?
-
Masa molecular de un gas encerrado y masa de otro gas para un valor de presión final
En un recipiente de paredes rígidas y de 20 L de capacidad hay encerrados 50.19 g de un gas formado por C, H, y O a  que ejercen una presión de 1.4 atm.
que ejercen una presión de 1.4 atm.
a) Halla la masa molecular del gas.
b) Calcula la masa del monóxido de carbono que hay que añadir para que la presión resultante sea de 2.0 atm, manteniendo la temperatura constante.
Datos: C = 12 ; O = 16 ; H = 1 ; 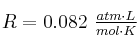
-
Aplicación de la ley general de los gases a varios sistemas (6028)
Completa la siguiente tabla para cada sustancia gaseosa:
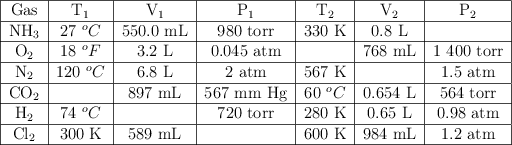
 Leyes de los gases
Leyes de los gases