-
Estequiometría: reactivo limitante y rendimiento (2861)
Dada la siguiente reacción química, en la que se hacen reaccionar 36 g de 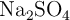 , con una pureza del
, con una pureza del 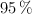 , y 27 g de
, y 27 g de 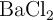 , con pureza del
, con pureza del 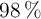 , y teniendo en cuenta que el rendimiento de la reacción es del
, y teniendo en cuenta que el rendimiento de la reacción es del 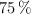 , calcula:
, calcula:

a) Ecuación balanceada.
b) El número de moles y gramos formados en la reacción.
Datos: Na = 23 ; Ba = 137.3 ; S = 32; O = 16 ; Cl = 35.5
-
Descomposición térmica de caliza: balanceo y pureza 0001
La caliza (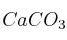 ) se descompone, calentándose, en cal viva (CaO) y dióxido de carbono.
) se descompone, calentándose, en cal viva (CaO) y dióxido de carbono.
a) Escribe la reacción química y ajústala.
b) Calcula el peso de cal viva que puede prepararse calentando 200 g de caliza con una pureza del 95 de
de 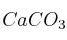 .
.
Masas atómicas: Ca = 40 ; C = 12 ; O = 16
-
Ajustar reacción y pureza de un reactivo 0001
Si añadimos cáscara de huevo a un vaso de vinagre veremos que la cáscara "desaparece" pasado un tiempo. La reacción que tiene lugar es:
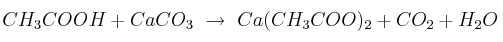
a) Ajusta la reacción
b) Determina la concentración de 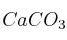 en la cáscara de huevo si se recogen 0,2 L de
en la cáscara de huevo si se recogen 0,2 L de  (en c.n) cuando se echaron 2 g de cáscara al vinagre.
(en c.n) cuando se echaron 2 g de cáscara al vinagre.
-
Reactivos con impurezas 0001
Un mineral de hierro contiene un 34,6 de
de 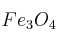 siendo el resto impurezas ¿Cuántas toneladas de mineral se deberían procesar para obtener 1 tonelada de hierro metálico, si el rendimiento es del 80
siendo el resto impurezas ¿Cuántas toneladas de mineral se deberían procesar para obtener 1 tonelada de hierro metálico, si el rendimiento es del 80 ?
?
-
Reacciones químicas: reactivos impuros (2348)
Calcula la cantidad de cal viva (CaO) que puede prepararse calentando 200 g de caliza con una pureza del 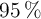 en
en 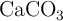 . La reacción de la descomposición térmica del carbonato de calcio es:
. La reacción de la descomposición térmica del carbonato de calcio es:
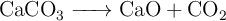
 Pureza
Pureza