-
Masa atómica en un óxido metálico 0001
Un óxido triatómico del tipo 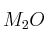 tiene un
tiene un 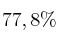 en masa del metal. Calcula la masa atómica del metal.
en masa del metal. Calcula la masa atómica del metal.
-
Reacciones: Composición centesimal y fórmula empírica 0001
La combustión de 25 g de un hidrocarburo dio 56,25 g de agua y 68,75 g de dióxido de carbono. Determina:
a) La composición centesimal de la muestra.
b) Su fórmula empírica.
c) El compuesto del que podría tratarse.
d) El número de moles de oxígeno necesarios para la combustión.
-
Determinación de la fórmula empírica y molecular 0001
La hexametilendiamina (M = 116,2) es un compuesto que contiene solo
carbono, hidrógeno y nitrógeno y se usa en la producción de nailon. Cuando se
queman 6,315 g de hexametilendiamina con oxígeno se obtienen 14,36 g de dióxido de carbono y 7,832 g de agua. Determina las fórmulas empírica y molecular de la hexametilendiamina.
-
Fórmula molecular a partir de la fórmula empírica y la masa molecular (2533)
¿Cuál es la fórmula molecular de una sustancia cuya análisis arrojó que su fórmula empírica es 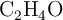 y masa molecular es 88 g/mol?
y masa molecular es 88 g/mol?
-
Formula empírica a partir de porcentaje en masa (2532)
Un óxido de magnesio contiene 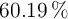 de metal. ¿Cuál es su fórmula empírica?
de metal. ¿Cuál es su fórmula empírica?
 Fórmula empírica
Fórmula empírica