-
Masa de HCl, moléculas y átomos de Cl en un volumen de disolución (6636)
En el laboratorio tenemos un ácido clorhídrico del 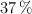 de riqueza en masa y
de riqueza en masa y 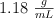 de densidad. Si cogemos 70 mL del contenido de esa botella, calcula:
de densidad. Si cogemos 70 mL del contenido de esa botella, calcula:
a) ¿Qué masa de ácido clorhídrico estaremos tomando?
b) ¿Cuántos moles son?
c) ¿Cuántas moléculas contiene? ¿Cuántos átomos de cloro hay?
-
Volumen de NaOH necesario para neutralizar un volumen de ácido sulfúrico (6630)
Calcula cuántos mL de hidróxido de sodio 2.0 M se necesitan para que reaccionen completamente con 10.0 mL de una disolución de ácido sulfúrico de densidad 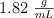 y del
y del 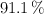 en peso.
en peso.
-
Volumen de etanol que se obtiene al hacer reaccionar masas iguales de reactivos (6607)
El ácido etanoico 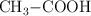 , se obtiene industrialmente por reacción del metanol con el monóxido de carbono:
, se obtiene industrialmente por reacción del metanol con el monóxido de carbono:
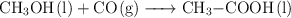
Calcula el volumen de disolución de ácido etanoico, del 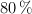 en masa y densidad 1.070 g/mL, que se podrá obtener al hacer reaccionar 20 kg de metanol con 20 kg de monóxido de carbono, si el rendimiento de la reacción es del
en masa y densidad 1.070 g/mL, que se podrá obtener al hacer reaccionar 20 kg de metanol con 20 kg de monóxido de carbono, si el rendimiento de la reacción es del 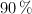 .
.
-
Repaso: Concentración en g/mL y en porcentaje en masa (6606)
Se prepara una disolución de cloruro de sodio en agua disolviendo 12 g de cloruro de sodio en 98 g de agua, de modo cuando está todo disuelto el volumen es de 100 mL:
a) ¿Cuál es la concentración en g/mL?
b) ¿Cuál es el 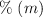 si evaporamos 10 mL de la disolución?
si evaporamos 10 mL de la disolución?
c) ¿Qué cantidad de sal quedará disuelta en la disolución tras la evaporación?
-
Preparación de una disolución diluida de ácido y posterior neutralización (6581)
a) Se dispone en el laboratorio de una disolución de 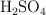 concentrado del
concentrado del 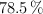 en riqueza y
en riqueza y 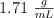 de densidad. Calcula el volumen de esta disolución necesario para preparar medio litro de una disolución diluida de concentración 0.250 M.
de densidad. Calcula el volumen de esta disolución necesario para preparar medio litro de una disolución diluida de concentración 0.250 M.
b) Este ácido se utilizó para valorar 0.420 g de una mezcla de 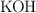 y
y 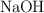 que, una vez disuelta en agua, reaccionó con 17.40 mL del ácido sulfúrico 0.250 M. Calcula la composición de la mezcla en gramos.
que, una vez disuelta en agua, reaccionó con 17.40 mL del ácido sulfúrico 0.250 M. Calcula la composición de la mezcla en gramos.
 Porcentaje en masa
Porcentaje en masa