-
Aplicación de la ecuación de los gases ideales 0001
Un mol de un gas ocupa un volumen de 10 L cuando está sometido a una presión de 745 mm Hg y a una temperatura de -138 ºC. ¿Se trata de un gas ideal?
-
Selectividad junio 2015 Andalucía: gases y leyes ponderales (3321)
Una cantidad de dioxígeno ocupa un volumen de 825 mL a 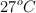 y una presión de 0.8 atm. Calcula:
y una presión de 0.8 atm. Calcula:
a) ¿Cuántos gramos hay en la muestra?
b) ¿Qué volumen ocupará la muestra en condiciones normales?
c) ¿Cuántos átomos de oxígeno hay en la muestra?
Datos: O = 16 ; 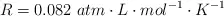
-
Temperatura final de los gases en un cilindro tras la combustión
En el motor de un coche se comprime una mezcla de aire y gasolina en los cilindros antes de encenderse. En un motor típico se tiene una relación de compresión de 9 a 1, es decir, el gas en los cilindros se comprime a 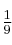 de su volumen original. La presión inicial de la mezcla es de 1 atm y la temperatura inicial es de
de su volumen original. La presión inicial de la mezcla es de 1 atm y la temperatura inicial es de 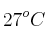 , si la presión después de la conversión es de 21.7 atm, ¿cuál es la temperatura del gas comprimido?
, si la presión después de la conversión es de 21.7 atm, ¿cuál es la temperatura del gas comprimido?
-
Volumen ocupado por una masa de helio 0001
Calcula el volumen que ocupan 8 g de helio gaseoso en condiciones normales. (Masa atómica del He = 2)
-
Masa de un volumen de gas 0001
Determina la masa de un litro de metano cuando está en condiciones normales, sabiendo que la masa molecular del metano es 16 g/mol.
 Gases
Gases