-
Ejercicio solubilidad selectividad junio 2012
En un vaso de agua se pone una cierta cantidad de una sal poco soluble, de fórmula general 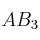 y no se disuelve completamente. El producto de solubilidad de la sal es
y no se disuelve completamente. El producto de solubilidad de la sal es 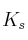 :
:
a) Deduce la expresión que relaciona la concentración molar de 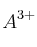 con el producto de solubilidad de la sal.
con el producto de solubilidad de la sal.
b) Si se añade una cantidad de sal muy soluble de 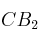 . Indica razonadamente la variación que se produce en la solubilidad de la sal
. Indica razonadamente la variación que se produce en la solubilidad de la sal 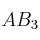 .
.
c) Si B es el ion 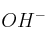 ¿Cómo influye la disminución del pH en la solubilidad del compuesto?
¿Cómo influye la disminución del pH en la solubilidad del compuesto?
-
Equilibrio sólido-líquido: Producto de solubilidad y solubilidad (1774)
A cierta temperatura el producto de solubilidad en agua del AgI es 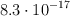 . Para esa temperatura, calcula la solubilidad molar del compuesto en:
. Para esa temperatura, calcula la solubilidad molar del compuesto en:
a) Una disolución 0.1 M de 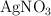 .
.
b) Una disolución de ácido yodhídrico de pH = 2
-
Equilibrios heterogéneos: Solubilidad y producto de solubilidad (1411)
A  la solubilidad del
la solubilidad del 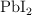 en agua pura es 0.7 g/L. Calcula:
en agua pura es 0.7 g/L. Calcula:
a) El producto de solubilidad.
b) La solubilidad del 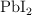 a esa temperatura en una disolución 0.1 M de KI .
a esa temperatura en una disolución 0.1 M de KI .
Masas atómicas: I = 127 ; Pb = 207.
-
Equilibrios heterogéneos: Solubilidad (1401)
A  , la solubilidad del fluoruro de bario en agua es 1.30 g/L. Calcula a esa temperatura:
, la solubilidad del fluoruro de bario en agua es 1.30 g/L. Calcula a esa temperatura:
a) La solubilidad del fluoruro de bario expresada en mol/L.
b) El producto de solubilidad del fluoruro de bario.
c) La solubilidad del fluoruro de bario, expresada en mol/L, en una disolución acuosa 0.5 M de fluoruro de sodio.
Datos: F = 19 ; Ba = 137.
-
EBAU Andalucía: química (junio 2010) - ejercicio A.3 (1036)
Se dispone de una disolución acuosa saturada de 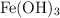 , compuesto poco soluble.
, compuesto poco soluble.
a) Escribe la expresión del producto de solubilidad para este compuesto.
b) Deduce la expresión que permite conocer la solubilidad del hidróxido a partir del producto de solubilidad.
c) Razona cómo varía la solubilidad del hidróxido al aumentar el pH de la disolución.
 Solubilidad
Solubilidad