-
Reactivos con impurezas 0002
¿Qué masa de trióxido de azufre (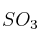 ) se podrá obtener a partir de 250 gramos de azufre con un 98
) se podrá obtener a partir de 250 gramos de azufre con un 98 de pureza?
de pureza?
La reacción que tiene lugar es: 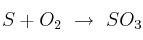
-
Reacciones químicas: reactivos impuros 0002
Se hace reaccionar 150 gramos de una muestra de 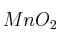 que posee una pureza del 87
que posee una pureza del 87 con suficiente cantidad de HCl. Determina:
con suficiente cantidad de HCl. Determina:
a) Moles y masa del agua que se obtiene.
b) Moles y masa de cloro.
-
Reacciones químicas: estequiometría, moles y volumen de gases (2179)
Calcular el volumen de 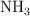 en litros, a 530 K y a una presión de 3.10 atm, que se obtendría si se hacen reaccionar 41 g de
en litros, a 530 K y a una presión de 3.10 atm, que se obtendría si se hacen reaccionar 41 g de 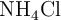 al
al 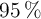 de pureza con suficiente
de pureza con suficiente 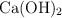 .
.
-
Reacciones químicas: riqueza de los reactivos (1592)
Para determinar la riqueza de una muestra de cinc se toman 50 g de la misma y se tratan con una disolución de ácido clorhídrico del 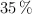 en peso de riqueza y densidad 1.18 g/mL, consumiéndose 129 mL. Calcula el porcentaje de cinc de la muestra y la molaridad de la disolución de ácido clorhídrico.
en peso de riqueza y densidad 1.18 g/mL, consumiéndose 129 mL. Calcula el porcentaje de cinc de la muestra y la molaridad de la disolución de ácido clorhídrico.
Masas atómicas 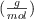 : Zn = 65.4 ; H = 1 ; Cl = 35.5
: Zn = 65.4 ; H = 1 ; Cl = 35.5
-
Reacciones químicas: pureza de los reactivos 0001
Se desean obtener 5 L de oxígeno, medidos a 15 ºC y 725 mm Hg, por descomposición del clorato de potasio en oxígeno y cloruro de potasio. ¿Qué peso de clorato de potasio comercial, que contiene un 96,5 en peso puro, es necesario utilizar?
en peso puro, es necesario utilizar?
 Pureza
Pureza