-
Compuestos iónicos: Puntos de fusión 0001
La tabla que sigue corresponde a los puntos de fusión de distintos sólidos iónicos:
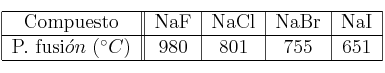
Considerando los valores anteriores: a) Indica cómo variará la energía reticular en este grupo de compuestos; b) Razona cuál es la causa de esa variación.
-
Configuración electrónica y tipo de enlace 0001
Los elementos A, B, C y D pertenecen al mismo periodo y tienen 1, 3, 5 y 7 electrones de valencia, respectivamente. Indica, razonando la respuesta:
a) Qué elemento tiene la energía de ionización más alta y cuál la más baja.
b) Qué fórmulas tendrán los compuestos A-D y B-D.
c) Si el compuesto formado por B y D será iónico o covalente.
-
Ciclo de Born-Haber y energía reticular (1852)
a) Haz un esquema del ciclo de Born-Haber para el NaCl.
b) Calcula la energía reticular del NaCl(s), a partir de los siguientes datos:
– Entalpía de sublimación del sodio = 108 kJ/mol
– Entalpía de disociación del cloro = 243.2 kJ/mol
– Entalpía de ionización del sodio = 495.7 kJ/mol
– Afinidad electrónica del cloro = -348 kJ/mol
– Entalpía de formación del cloruro de sodio = -401.8 kJ/mol
-
Enlace químico y propiedades físicas (1797)
Dados los siguientes compuestos: 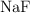 ,
, 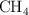 ,
, 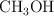 :
:
a) Indica el tipo de enlace.
b) Ordena de mayor a menor según su punto de ebullición. Razona tu respuesta.
c) Justifica la solubilidad o no en agua.
-
Enlace iónico: ciclo de Born-Haber 0002
Diseña el ciclo de Born-Haber para calcular la energía reticular del 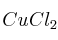 a partir del cobre metálico y del cloro gaseoso. Indica todas las magnitudes que serían necesarias para hacer el cálculo.
a partir del cobre metálico y del cloro gaseoso. Indica todas las magnitudes que serían necesarias para hacer el cálculo.
 Iónico
Iónico