-
PAU cinética química 0009
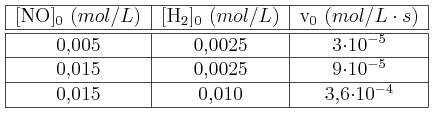
En la reacción 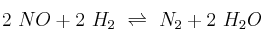 , a 1100 K, se obtuvieron los siguientes datos:
, a 1100 K, se obtuvieron los siguientes datos:
Constante velocidad
Calcula el orden de reacción y el valor de la constante de velocidad.
-
PAU cinética química 0006
La reacción 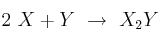 tiene órdenes parciales 2 y 1 respectivamente.
tiene órdenes parciales 2 y 1 respectivamente.
a) ¿Cuál es el orden total de reacción? Escribe la ecuación de velocidad del proceso.
b) ¿Qué relación existe entre la velocidad de desaparición de X y la de aparición de 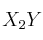 ?
?
c) ¿En qué unidades se puede expresar la velocidad de esta reacción? ¿Y la constante de velocidad?
d) ¿De qué factor depende el valor de la constante de velocidad de esta reacción?
-
PAU cinética química 0005
Para la reacción en fase gaseosa:
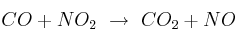
la ecuación de velocidad es ![v = k\ [NO_2]^2 v = k\ [NO_2]^2](local/cache-TeX/8814f26d2d5e39de717e99347b863917.png) . Justifica si son verdaderas o falsas las siguientes afirmaciones:
. Justifica si son verdaderas o falsas las siguientes afirmaciones:
a) La velocidad de desaparición del CO es igual que la velocidad de desaparición del 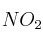 .
.
b) La constante de velocidad no depende de la temperatura porque la reacción se produce en fase gaseosa.
c) El orden total de la reacción es 2.
d) Las unidades de la constante de velocidad serán 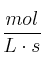
-
PAU cinética química 0003
La reacción en fase gaseosa 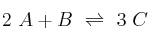 es una reacción elemental.
es una reacción elemental.
a) Formula la expresión para la ecuación de la velocidad.
b) Indica las unidades de la velocidad de reacción y de la constante cinética.
c) Justifica cómo afecta a la velocidad de reacción un aumento de la temperatura, a volumen constante.
d) Justifica cómo afecta a la velocidad de reacción un aumento del volumen, a temperatura constante.
-
Cuestión cinética química 0004
Explica de forma razonada por qué un aumento de la temperatura provoca un aumento mucho mayor de la velocidad de reacción.
 Constante velocidad
Constante velocidad