-
Relaciones estequiométricas en una reacción 0001
El peróxido de hidrógeno (líquido) se descompone en agua (líquido) y oxígeno (gas), liberando gran cantidad de energía:
a) ¿Cuál será la masa de agua que se obtiene cuando se descomponen 250 mL de peróxido de hidrógeno?
b) ¿Qué volumen de oxígeno se obtendrá, medido a 30 ºC y 1,2 atm?
c) ¿Cuántas moléculas de oxígeno habrá en el volumen calculado?
Datos: C = 12 ; H = 1 ; O = 16 ; 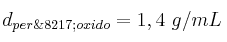
-
Masa de producto y estequiometría 0002
El hierro se puede oxidar según la reacción química sin ajustar: 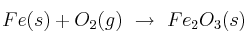 . Si se obtuvieron 34 g del óxido de hierro:
. Si se obtuvieron 34 g del óxido de hierro:
a) ¿Qué masa de hierro reaccionó?
b) ¿Cuántos litros de oxígeno, en condiciones normales, fueron necesarios en la reacción?
Datos: Fe = 56 ; O = 16
-
Reacción química: reactivos gaseosos 0002
El amoniaco se puede obtener a partir de nitrógeno e hidrógeno, dándose la reacción en estado gaseoso. Si la temperatura del proceso es 145 ºC y la presión 1 atm:
a) Escribe y ajusta la reacción.
b) Calcula la masa de amoniaco que se obtendrá cuando reaccionen 200 L de hidrógeno con exceso de nitrógeno.
c) ¿Cuál será el volumen de amoniaco obtenido en las condiciones del proceso?
d) ¿Qué tipo de reacción es la que se produce?
Datos: N = 14 ; H = 1
-
Estequiometría en reacción de neutralización (2689)
En un recipiente se mezclaron 300 mL de disolución de ácido bromhídrico (HBr) 0.25 M con 750 mL de disolución 0.1 M de hidróxido de potasio (KOH). Los gramos de bromuro de potasio (KBr) (M=119 u) obtenidos en la mezcla fueron:
a) 0.46 g
b) 4.6 g
c) 8.9 g
d) 0.89 g
-
Reacciones químicas: relación másica entre sustancias 0001
Responde a las preguntas sobre la reacción: 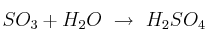 :
:
a) ¿Qué masa de 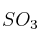 reacciona con 0,65 g de
reacciona con 0,65 g de 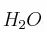 ?
?
b) ¿Cuántos mol de 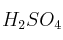 se obtienen al reaccionar 0,65 g de
se obtienen al reaccionar 0,65 g de 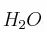 ?
?
Masas atómicas: H = 1; O = 16; S = 32
 Reacciones químicas
Reacciones químicas