-
Composición de una aleación que se hace reaccionar con ácido
Una aleación metálica de sodio y hierro(II) de 2.00 g de masa se trata con una cantidad suficiente de ácido clorhídrico, desprendiéndose 0.815 L de hidrógeno, medidos en condiciones normales. Calcula:
a) La composición porcentual en masa de aleación.
b) La masa sólida formada.
Na: 23 ; Fe = 56 ; H = 1.
-
Masa de alumnio impuro para reaccionar con una disolución dada (6589)
¿Qué masa de un aluminio comercial al 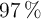 de riqueza es necesaria para la reacción completa con 100 mL de un ácido clohídrico comercial al
de riqueza es necesaria para la reacción completa con 100 mL de un ácido clohídrico comercial al 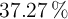 de pureza y densidad
de pureza y densidad 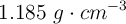 ?
?
Datos: H = 1 ; Cl = 35.5 ; Al = 27.
-
Reactivo limitante y en exceso en la neutralización de HCl y NaOH (6520)
Se añaden 20 mL de ácido clorhídrico 8 M a un matraz que contiene 100 mL de una disolución de hidróxido de sodio 1.5 M, formándose cloruro de sodio y agua.
a) Escribe y ajusta la reacción.
b) Indicar cuál es el reactivo limitante y cuál está exceso.
c) Calcula la cantidad del reactivo en exceso que queda sin reaccionar.
Masas atómicas: H = 1; Cl =35.5
-
Masa de fosfato de magnesio que se forma con 10 g de cabonato de magnesio
Al reaccionar 10 g de carbonato de magnesio con exceso de ácido fosfórico, ¿qué cantidad de sal se produce?
-
Volumen de hidrógeno y masa de HCl en la reacción con el magnesio (6484)
El magnesio reacciona con ácido clorhídrico para formar cloruro de magnesio y desprender dihidrógeno.
a) Escribe y ajusta la reacción.
b) ¿Qué volumen de gas hidrógeno a 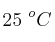 y 700 mm Hg se desprenderá al hacer reaccionar 7.2 g de magnesio con ácido clorhídrico en exceso?
y 700 mm Hg se desprenderá al hacer reaccionar 7.2 g de magnesio con ácido clorhídrico en exceso?
c) ¿Qué cantidad de ácido clorhídrico tiene que reaccionar para obtener 50 L de gas hidrógeno medidos en condiciones normales?
Datos: 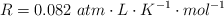 ; Mg = 24 ; H = 1 ; Cl = 35.5
; Mg = 24 ; H = 1 ; Cl = 35.5
 Ajuste
Ajuste