-
Volumen de CO2 y masa de H2O en la combustión del etano (7005)
Cuando el etano (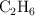 ) se quema con oxígeno se producen dióxido de carbono y agua. Si el proceso se da en condiciones normales, calcula:
) se quema con oxígeno se producen dióxido de carbono y agua. Si el proceso se da en condiciones normales, calcula:
a) El volumen de dióxido de carbono que se obtiene al quemar 80 g de etano.
b) La masa de agua que se produce.
Masas atómicas: C = 12 ; H = 1 ; O = 16.
-
Relación másica en la neutralización de un ácido y una base (7004)
La reacción de neutralización entre el ácido clorhídrico y el cinc, en medio acuoso, produce cloruro de cinc e hidrógeno gaseoso. Si tras la reacción se recogen 12.5 L de hidrógeno, medidos en condiciones normales, calcula:
a) La masa de cada reactivo que ha reaccionado.
b) Los moles de cloruro de cinc producidos.
Masas atómicas: Zn = 65.4 ; H = 1 ; Cl = 35.5
-
Relación estequiométrica y másica en una reacción química (7011)
Responde a las preguntas a partir de la siguiente reacción química:

a) ¿Cuántos gramos de 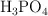 reaccionan con 5.70 moles de
reaccionan con 5.70 moles de 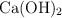 ?
?
b) ¿Cuántos moles de agua se producen si se obtienen 500 g de 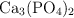 ?
?
c) ¿Cuántos gramos de 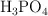 son necesarios para producir 275 g de agua?
son necesarios para producir 275 g de agua?
Masas atómicas: Ca = 40 ; P = 31 ; O = 16 ; H = 1.
-
Masa de cromo y moléculas de óxido de aluminio que se obtienen tras reacción (6997)
Cuando el óxido de cromo(III) reacciona con aluminio se forman el óxido de aluminio y cromo metálico. Si se hacen reaccionar 125 g de óxido de cromo(III) con exceso de aluminio:
a) ¿Qué masa de cromo se obtiene?
b) ¿Cuántas moléculas de óxido de aluminio se formarán al final de la reacción?
Datos: Al = 27 ; O = 16 ; Cr = 52 ; 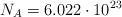 .
.
-
Masas de productos al hacer reaccionar sulfato de sodio con cloruro de bario (6986)
Se hacen reaccionar 125 g de sulfato de sodio (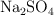 ) con un exceso de cloruro de bario. Calcula las masas de cloruro de sodio y de sulfato de bario (
) con un exceso de cloruro de bario. Calcula las masas de cloruro de sodio y de sulfato de bario (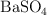 ) que se producen. La reacción tiene lugar en disolución acuosa.
) que se producen. La reacción tiene lugar en disolución acuosa.
Masas atómicas: Ba = 137.3 ; Cl = 35.5 ; S = 32 ; O = 16 ; Na = 23.
 Reacciones químicas
Reacciones químicas