-
Estructura de Lewis e hibridación 0001
a) Escribe las estructuras de Lewis correspondientes a las moléculas etano (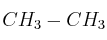 ) y eteno (
) y eteno (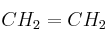 ).
).
b) Explica qué tipo de hibridación tiene el carbono en cada compuesto.
-
Ciclo de Born-Haber y energía reticular (1852)
a) Haz un esquema del ciclo de Born-Haber para el NaCl.
b) Calcula la energía reticular del NaCl(s), a partir de los siguientes datos:
– Entalpía de sublimación del sodio = 108 kJ/mol
– Entalpía de disociación del cloro = 243.2 kJ/mol
– Entalpía de ionización del sodio = 495.7 kJ/mol
– Afinidad electrónica del cloro = -348 kJ/mol
– Entalpía de formación del cloruro de sodio = -401.8 kJ/mol
-
Estructura de Lewis y polaridad 0001
a) Escribe la estructura de Lewis para las moléculas 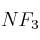 y
y 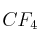 .
.
b) Dibuja la geometría de cada molécula según la Teoría de la Repulsión de los Pares de Electrones de la Capa de Valencia.
c) Considerando las geometrías moleculares, razona acerca de la polaridad de ambas moléculas.
-
Propiedades periódicas: Radio atómico 0001
Las dos tablas siguientes corresponden a radios atómicos:
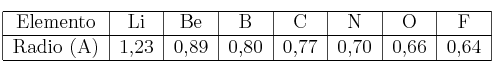
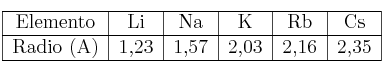
a) Justifica la variación del radio en el periodo.
b) Justifica la variación del radio en el grupo.
-
Configuración electrónica de iones estables 0001
Los números atómicos de los elemento Br y Rb son 35 y 37, respectivamente.
a) Escribe la configuración electrónica de ambos elementos.
b) Indica el ion más estable de cada elemento y su configuración electrónica.
c) Razona cuál de los dos iones tendrá mayor radio iónico.
 EBAU
EBAU